
科目: 来源: 题型:
【题目】化学是一门以实验为基础的学科,下列关于高中课本中的实验说法正确的是
A. 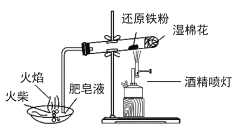 铁与水蒸气反应,湿棉花可以为反应提供原料
铁与水蒸气反应,湿棉花可以为反应提供原料
B. 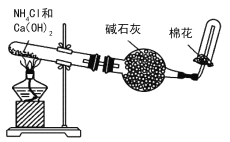 实验室制氨气,干棉花可以吸收多余的氨气以免污染环境
实验室制氨气,干棉花可以吸收多余的氨气以免污染环境
C.  实验室制乙酸乙酯,m试管中物质只有乙醇、浓硫酸和乙酸
实验室制乙酸乙酯,m试管中物质只有乙醇、浓硫酸和乙酸
D. 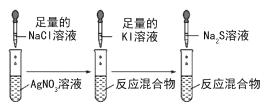 沉淀溶解转化实验,不能用来说明Ksp(AgCl)>Ksp(AgI)>Ksp(Ag2S)
沉淀溶解转化实验,不能用来说明Ksp(AgCl)>Ksp(AgI)>Ksp(Ag2S)
查看答案和解析>>
科目: 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
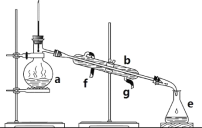
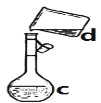
(1)写出下列仪器的名称:a.____________,b.___________,
(2)若利用装置分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,温度计水银球的位置在______处。
Ⅱ.配制一定物质的量浓度的溶液是化学实验室的基本实验操作之一。请回答下列问题:
(3)配制0.5 mol/L的硫酸溶液450 mL,需用量筒量取质量分数98%、密度1.84 g/cm3的浓硫酸的体积为_____mL,如果实验室有15 mL、20 mL、50 mL 量筒,应最好选用_____mL量筒。
(4)配制上述溶液,除用到量筒、烧杯、玻璃棒外,还需要的两种玻璃仪器是_____、_______。
(5)配制时,其正确的操作顺序是__________(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有水的烧杯中加入浓硫酸稀释
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(6)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。若没有进行A操作___________;若定容时俯视刻度线_______
查看答案和解析>>
科目: 来源: 题型:
【题目】臭氧的脱硝反应为:2NO2(g) + O3(g)![]() N2O5(g) + O2(g),一定条件下,向2.0L恒容密闭容器中充入2.0molNO2和1.0 molO3,一段时间后达到平衡。下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化。下列叙述正确的是( )
N2O5(g) + O2(g),一定条件下,向2.0L恒容密闭容器中充入2.0molNO2和1.0 molO3,一段时间后达到平衡。下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化。下列叙述正确的是( )
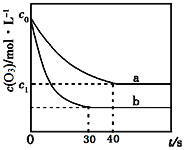
A. 反应2NO2(g) + O3(g)![]() N2O5(g) + O2(g) △S<0
N2O5(g) + O2(g) △S<0
B. 曲线b对应的条件改变可能是加入了催化剂,平衡常数Ka=Kb
C. 曲线b对应的条件改变可能是密闭容器的体积变为4.0L
D. 若c1=0.3mol·L-1,从反应开始到平衡时该反应的速率v(NO2)=0.005 mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成:

下列说法不正确的是
A. Y的分子式为C10H8O3
B. 由X制取Y的过程中可得到乙醇
C. 一定条件下,Y能发生加聚反应和缩聚反应
D. 等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为3∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】镍钴锰酸锂电池是一种高功率动力电池。采用废旧锂离子电池回收工艺制备镍钴锰酸锂三元正极材料(铝电极表面涂有LiNi1-x-yCoxMnyO2)的工艺流程如图所示:
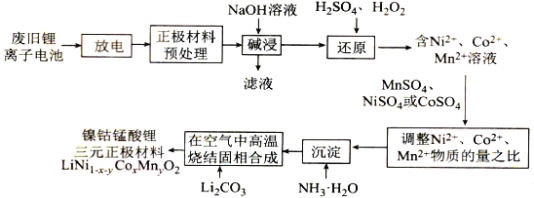
回答下列问题
(1)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是_______。
(2)能够提高“碱浸”效率的方法有______(至少写两种)。
(3)“碱浸”过程中,铝溶解的离子方程式为_____。
(4)实验室模拟“碱浸”后过滤的操作,过滤后需洗涤,简述洗涤的操作过程:_____。
(5)LiCoO2参与“还原”反应的离子方程式为_______。
(6)溶液温度和浸渍时间对钴的浸出率影响如图所示,则浸出过程的最佳条件是______。
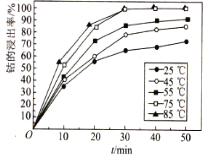
(7)已知溶液中Co2+的浓度为1.0mol·L-1,缓慢通入氨气,使其产生Co(OH)2沉淀,则Co2+沉淀完全时溶液的最小pH为______(已知:离子沉淀完全时c(Co2+)≤1.0×10-5mol·L-1,Ksp[Co(OH)2]=4.0×10-15,1g5=0.7,1g2=0.3,溶液体积变化忽略不计)。
查看答案和解析>>
科目: 来源: 题型:
【题目】卫生部严令禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。过氧化钙(CaO2)常用作杀菌剂、防腐剂,是一种白色固体,带有结晶水,通常还含有CaO。
I、制备过氧化钙。
某实验小组选用如下装置制备过氧化钙。已知化学反应Ca2++H2O2+2NH3+xH2O===CaO2·xH2O↓+2NH4+。在碱性环境中制取CaO2·xH2O的装置如下图:
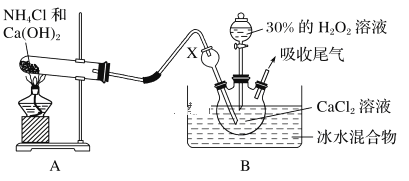
(1)装置B中仪器X的作用是_____________;反应在冰水浴中进行的原因是_________________。
(2)反应结束后,经________、________、低温烘干获得CaO2·xH2O。
II、含量测定。
(1)称取13.52 g过氧化钙样品,灼热时发生如下反应:2[CaO2·xH2O]→2CaO+O2↑+2xH2O,得到O2在标准状况下体积为672 mL,该样品中CaO2的物质的量为____________。
(2)另取同一样品13.52 g,溶于适量稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 7.0 g。样品中杂质CaO的质量为_____________;样品CaO2·xH2O中的x值为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用“化学计量在实验中的应用”的相关知识进行填空(设NA表示阿伏加德罗常数的值)。
(1)标准状况下,0.2 mol氨气的体积是__________, 其中含有的NH3分子数是__________,
(2) 20℃时,饱和KCl溶液的密度为0.745g·cm﹣3,物质的量浓度为4.0 mol·L﹣1,则此溶液中KCl 的质量分数为______
(3)从500 mL 0.2 mol/L Na2SO4 溶液中取出10 mL,取出的Na2SO4溶液物质的量浓度为___mol/L;若将这10 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为______mol/L。
(4)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的摩尔质量是______;ACl2的化学式是_________。
(5)物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3∶2∶1时,三种溶液中Cl-的物质的量之比为________
(6)300mL Al2(SO4)3溶液中,含Al3+为1.62g,在该溶液中加入0.1mol/L Ba(OH)2溶300mL,反应后溶液中SO42﹣的物质的量的浓度为__________(混合体积看成两液体体积之和)
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需精确配制480mL0.100mol/L的CuSO4溶液,以下操作正确的是
A.称取7.68gCuSO4,配成500mL溶液
B.称取12.0g胆矾,配成500mL溶液
C.称取8.0gCuSO4,加入500mL水
D.称取12.5g胆矾,配成500mL溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】电解NO制备NH4NO3的工作原理如图所示,X、Y皆Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A。下列说法正确的是( )
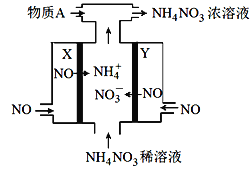
A. 物质A为NH3
B. X电极为电解池阳极
C. Y电极上发生了还原反应
D. Y电极反应式:NO-3e-+ 4OH-===NO3- +2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】同温同压下,等质量的 SO2气体和 SO3气体相比较,正确的说法是
A. 密度比为 4:5 B. 物质的量之比为 4:5
C. 体积比为 1:1 D. 原子数之比为 3:4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com