
科目: 来源: 题型:
【题目】1999年比利时发生奶粉受二噁英污染事件。二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一,2,3,7,8-四氯二苯并二噁英是其中的一种,结构如图,下列说法中不正确的是 ( )
![]()
A. 它的分子式为C12H4O2Cl4B. 它不能发生加成反应
C. 它的一溴取代物有一种D. 此分子中共平面的原子最多有22个
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向明矾溶液中加入少量的氢氧化钡溶液:2Al3++![]() +3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓
+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓
B. 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O
C. 向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:![]() +OH-=NH3·H2O
+OH-=NH3·H2O
D. 含等物质的量的MgCl2、Ba(OH)2和HC1溶液混合:Mg2++2OH-=Mg(OH)2↓
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F、G、W是原子序数依次增大的8种元素,A元素原子的2p原子轨道上有 2个未成对的电子,B元素在同周期中原子半径最大,与A可形成原子个数比为1 : 1和2 : 1的两种化合物,C单质是一种常见的半导体材料,F有 9个原子轨道,G的单质是一种常见金属,W能形成红色(或砖红色)的W2A和黑色的WA两种氧化物。
(1)A元素在元素周期表中的位置是__________;写出B元素与A形成原子个数比为1 : 1的化合物的电子式____________________________ ;
(2)写出C基态时的价电子排布式:_______________________;
(3)D、E、F三者第一电离能从大到小的顺序是__________(用元素符号及“ > ”表示)。
(4)G位于元素周期表的位置是_________________, G3+比G2+稳定,原因是____________;
(5)W能形成红色(或砖红色)的W2A, W2A的化学式为_______________ ,W在周期表的_____ 区。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 1mol 铁和高温水蒸气完全反应转移的电子数为3NA
B. 常温常压下,1mol 氦气含有的原子数为NA
C. 标准状况下,11. 2 L 乙醇含有的分子数目为0. 5NA
D. 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的有
①0.1mol丙烯酸中含有双键的数目为0.1NA
②12g金刚石中,碳碳共价键数为4NA
③常温下,21g C3H6和C4H8的混合物中含有的碳原子数为1.5NA
④2g ![]() 中含有的质子数、中子数、电子数均为NA
中含有的质子数、中子数、电子数均为NA
⑤常温常压下,S2和S6的混合物共6.4g,其中所含硫原子数一定为0.2NA
⑥10mL 18mol/L的浓硫酸与足量的镁反应时转移的电子数为0.18NA
A. ①⑥B. ④⑤⑥C. ③④⑤D. ①②⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇及其化合物可制成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的烯丙醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
①基态镍原子的价电子排布式为___________________。
②1 mol CH2=CH-CH2OH含____molσ键,烯丙醇分子中碳原子的杂化类型为________。
③ Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2- 和[Ni(SCN)2]- 等,与CN-互为等电子体的分子为____________。
(2)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
①CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为_____________; lmol O22+中含有的π键数目为_______________。
②将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为____________。
③乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是_______________;分子中处于同一直线上的原子数目最多为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】美国《Scinece》杂志曾报道科学家合成和分离出含高能正离子![]() 的化合物N5AsF6,有研究者预想合成一个纯粹由氮组成的新物种
的化合物N5AsF6,有研究者预想合成一个纯粹由氮组成的新物种 ![]() ,若
,若![]() 离子中每个氮原子均满足8电子结构,下列关于含氮微粒的表述正确的是
离子中每个氮原子均满足8电子结构,下列关于含氮微粒的表述正确的是
A. ![]() 中N原子间形成离子键B. N5AsF6中As的化合价为+1
中N原子间形成离子键B. N5AsF6中As的化合价为+1
C. ![]() 的摩尔质量为112D.
的摩尔质量为112D. ![]() 所含质子数为21
所含质子数为21
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。下列有关说法不正确的是
A. 制冷剂氟里昂-12(CCl2F2)的研发利用,充分体现了元素周期表的指导作用
B. 通过测定物质中![]() 的含量可以推断文物的年代
的含量可以推断文物的年代
C. 门捷列夫预言的“类铝” 镓(Ga)元素的发现,证实了元素周期律的科学性
D. 过渡元素Ti、Mo、W等的单质有耐高温,耐腐蚀的特点,其合金可以制造火箭、导弹、宇宙飞船等
查看答案和解析>>
科目: 来源: 题型:
【题目】有A,B,C,D,E五种元素,其中A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D。
回答下列问题:
(1) C原子的价电子构型为csccpc+1 ,其中c为________, C原子的名称为__________ ;
(2)上述元素中,第一电离能最小的元素的原子结构示意图为__________________;
D的价电子排布图为______________________;E2D的电子式为__________________;
(3) 下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.
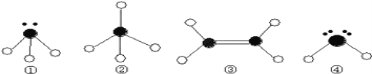
则在以上分子中,中心原子采用sp3杂化形成化学键的是___________(填写分子的化学式);
②分子中的键角是_____________; 在③的分子中有_______个σ键和_______个π键。
查看答案和解析>>
科目: 来源: 题型:
【题目】碘是人体中不可缺少的元素,为了预防碘缺乏,通常在精盐中添加一定的KIO3。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关资料,发现其检测原理是:KIO3 + 5KI + 3H2SO4 = 3I2 + 3K2SO4 + 3H2O
(1)用双线桥表示该反应中电子转移的方向和数目___________________________________,该反应中还原产物与氧化产物的质量之比是__________,0.2mol KIO3参加反应时,转移的电子为________mol。
(2)上面实验中用到一定物质的量浓度的稀硫酸,若配制1.0 mol/L的稀硫酸500mL,配制中需要用到的主要玻璃仪器有___________(填选项),需用18.0mol/L 浓硫酸_________mL。
a.100mL量筒 b.玻璃棒 c.100mL容量瓶 d.50mL量筒 e.胶头滴管
f.烧杯 g.500mL容量瓶
(3)下面操作造成所配稀硫酸溶液浓度偏高的有____________(填选项)。
a.溶解后溶液没有冷却到室温就转移;b.转移时没有洗涤烧杯、玻璃棒;c.转移过程中有少量液体流出;d.向容量瓶加水定容时眼睛俯视液面;e.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com