
科目: 来源: 题型:
【题目】将0.2mol MnO2和50mL 12mol·L-1盐酸混合后缓慢加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀,物质的量为x mol(不考虑盐酸的挥发),则x的取值范围是
A.x=0.3B.x<0.3C.0.3<x<0.6D.以上结论都不对
查看答案和解析>>
科目: 来源: 题型:
【题目】合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①CO(NH2)2(s)+H2O(1)2HN3(g)+CO2(g)ΔH=+133.6kJ/mol。关于该反应的下列说法正确的是____________(填序号)。
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度可使尿素的转化率增大
d.达到平衡后,缩小容器的体积,平衡向逆反应方向移动,达到平衡时NH3的浓度大于原平衡
②尿素在一定条件下可将氮的氧化物还原为氮气。
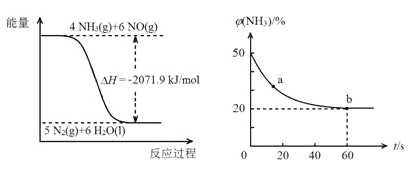
已知:
再结合①中的信息,则反应2CO(NH2)2(s)+6NO(g)5N2(g)+2CO2(g)+4H2O(1)的ΔH=______kJ/mol。
③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下应生成尿素:CO2(g)+2NH3(g)CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量随时间变化关系如图所示,氨气的平衡转化率为____________
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2,已知9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,恰好反应后,使溶液中的C元素全部以CO2形式逸出,所得溶液呈弱碱性,则溶液中离子浓度大小关系是c(Na+)>_________________________。
(3)用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH的浓度来制备纳米Cu2O,装置如图所示:
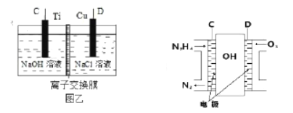
上述装置中阳极反应式为_________________________,该电解池中的离子交换膜为______________(填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第IB族。Cu2+的核外电子排布式为____________。
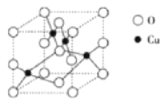
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为___________。
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间结构都是三角锥形,但NF3不易与Cu2-形成配离子,其原因是__________。
(4)Cu2O的熔点比Cu2S的________(填“高”或“低”)
查看答案和解析>>
科目: 来源: 题型:
【题目】卤代烃在碱性醇溶液中能发生消去反应。下面几种有机化合物的转化关系:
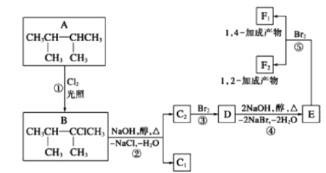
(1)根据系统命名法,化合物A的名称是_________
(2)写出物质D中所含官能团的名称_____________
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式___________
(4)C2的结构简式是____________,F1的结构简式是___________
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲酸的反应如下:
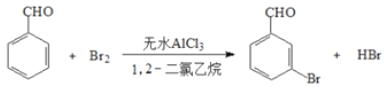
已知:(1)间溴苯甲醛温度过高时易被氧化
(2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点及相对分子质量见下表
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
相对分子质量 | 160 | 106 | 185 |
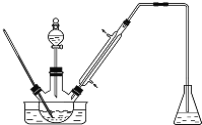
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如下图所示)缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液、有机层用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4·nH2O晶体
步骤4:减压蒸馏有机层,收集相应馏分。
(1)实验装置中冷凝管的主要作用是____________,锥形瓶中应为__________(填化学式)溶液
(2)步骤1反应过程出,为提高原料利用率,适宜的温度范围内(填序号)____________
A.>299℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10%NaHCO3溶液洗涤,是为了除去溶于有机层的____________(填化学式)
(4)步骤3中加入无水MgSO4固体的作用是___________________。
(5)步骤4中采用减压蒸馏,是为了防止_______________________________________。
(6)若实验中加入5.3g苯甲醛,得到3.7g间溴苯甲醛,则间溴苯甲醛产率为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)3-甲基-戊烯的结构简式为___________
(2)某炔的分子式为C4H4它是合成橡胶的中间体,它有多种同分异构体。
①写出它的一种链式结构的同分异构体的结构简式(提示:同一个碳原子上连接2个碳碳双链的结构不稳定)______________
②它有一种同分异构体,每个碳原子均达饱和,且碳与碳的夹角相同,该分子中碳原子形成的空间构型为__________________形
(3)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2消耗氧气6.72L(标准状况下),则该物质的实验式是________
(4)写出由甲苯制TNT的方程式______________________
查看答案和解析>>
科目: 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,会污染大气。采用NaClO、Ca(C1O)2溶液作为吸收剂可同时对烟气进行税硫、脱硝,下列说法正确的是
①SO2(g)+2OH-(aq)![]() SO32-(aq)+H2O(l) ΔH1=a KJ/mol
SO32-(aq)+H2O(l) ΔH1=a KJ/mol
②ClO-(aq)+SO32-(aq)![]() SO42-(aq)+Cl-(aq) ΔH2=b KJ/mol
SO42-(aq)+Cl-(aq) ΔH2=b KJ/mol
③CaSO4(s)![]() Ca2+(aq)+ SO42- (aq) ΔH3=c KJ/mol
Ca2+(aq)+ SO42- (aq) ΔH3=c KJ/mol
④SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)![]() CaSO4(s)+H2O(l)+Cl-(aq)ΔH4=dKJ/mol
CaSO4(s)+H2O(l)+Cl-(aq)ΔH4=dKJ/mol
A. 随着吸收反应的进行,吸收剂溶液的pH逐渐减小
B. 反应①、②均为氧化还原反应
C. 反应Ca(OH)2(aq)+H2SO4(aq)=CaSO4(s)+2H2O(1)的ΔH=-ckJ/mol
D. d=a+b+c
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验装置或操作正确的是
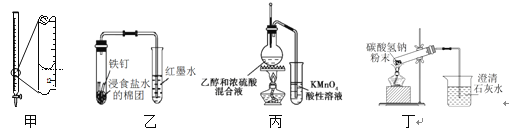
A. 装置甲液面读数为12.20 mL B. 装置乙可探究铁的吸氧腐蚀
C. 装置丙可检验乙烯的生成 D. 装置丁可验证碳酸氢钠受热分解
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列装置完成相关实验,合理的是( )
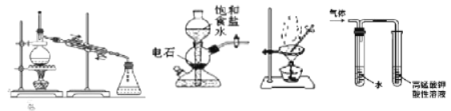
A. 提纯工业乙醇(含甲醇、水等杂质)的装置①
B. 实验室中若需制备较多量的乙炔可用装置②
C. 提纯含苯甲酸钠杂质的粗苯甲酸选择装置③
D. 检验溴乙烷与NaOH乙醇溶液加热制得的气体选择装置④
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式次氯酸镁[Mg2ClO(OH)3·H2O]微溶于水,不吸湿,相对稳定,是一种有开发价值的无机抗菌剂。某研发小组通过下列流程制备碱式次氯酸镁:
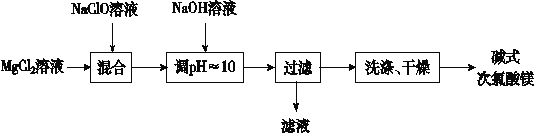
(1)上述流程中过滤操作需用的玻璃仪器有__________
(2)从上述流程中可以判断,滤液中可回收的主要物质是__________。
(3)NaClO溶液用Cl2与NaOH溶液反应获得,写出该反应的化学方程式:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com