
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.将5.85 g NaCl晶体溶入100 mL水中,制得1 mol·L-1NaCl溶液
B.将1体积c mol·L-1硫酸加入水中稀释为5体积,得到0.2c mol·L-1硫酸
C.将25 g无水CuSO4溶于水配制成100 mL溶液,其浓度为1 mol·L-1
D.用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏低
查看答案和解析>>
科目: 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、A13+、Cl-、SO42-、CO32-、A1O2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验: 下列说法正确的是
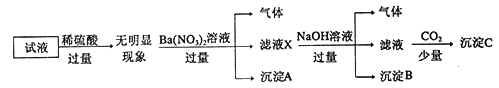
A. 原溶液中存在NH4+、Fe2+、Cl-、SO42-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 无法确定原试液中是否含有Al3+、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应的离子方程式书写正确的是

A. OH+HCl=H2O+ClB. Ca(OH)2+Cu2+=Ca2++Cu(OH)2
C. Fe+Cu2+=Cu+Fe2+D. Fe+2H+=Fe3++H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】下列体系中,离子可能大量共存的是( )
A.滴加KSCN显红色的溶液:NH、K+、Cl-、HCO
B.常温,水电离出的c(H+)=1×10-12 mol/L的溶液:Fe2+、Mg2+、SO![]() 、NO
、NO
C.使酚酞试剂显红色的溶液:Na+、Ba2+、NO、[Al(OH)4]-
D.加入Al能产生H2的溶液:K+、NH、CH3COO-、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 64 g SO2含有氧原子数为1NA
B. 物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C. 标准状况下,22.4 L H2O的分子数为1NA
D. 常温常压下,14 g N2含有分子数为0.5 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】如图用交叉分类法表示了一些概念之间的关系,其中不正确的是( )
X | Y | Z |
| |
A | 硫酸铜 | 盐 | 纯净物 | |
B | 碱性氧化物 | 金属氧化物 | 氧化物 | |
C | 酸性氧化物 | 非金属氧化物 | 氧化物 | |
D | 强电解质 | 电解质 | 化合物 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】锶(Sr)为第5周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。
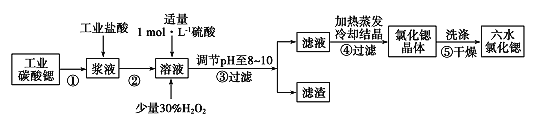
请回答:
(1)常温下,氯化锶溶液pH____7(已知金属性Ca<Sr)(填“大于”、“等于”或“小于”);
(2)写出在浆液中加入盐酸时主要发生的离子方程式________;
(3)步骤③所得滤渣的主要成分是______(填化学式),调节溶液pH至8~10,宜选用的试剂为 ______。
A.稀硫酸 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
(4)步骤⑤中,洗涤氯化锶晶体最好选用____。
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
(5)工业上用热风吹干六水氯化锶,选择的适宜温度范围是____(填字母)。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
查看答案和解析>>
科目: 来源: 题型:
【题目】在化学反应中,如果反应前后元素的化合价发生变化,就一定有_______转移,这类反应就属于_________反应。元素化合价升高,表明该元素的原子_____电子,含该元素的物质发生________反应;例如在Fe2O3+3CO![]() 2Fe+3CO2的化学反应中,_______是氧化剂,________是还原剂。
2Fe+3CO2的化学反应中,_______是氧化剂,________是还原剂。
查看答案和解析>>
科目: 来源: 题型:
【题目】 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
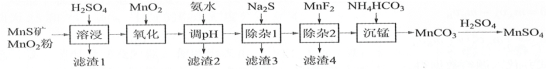
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是______
(6)写出“沉锰”的离子方程式_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2005年诺贝尔化学奖授予了研究烯烃复分解反应的科学家,以表彰他们作出的卓越贡献。烯烃复分解反应原理如下:C2H5CH=CHCH3+CH2=CH2![]() C2H5CH=CH2+CH2=CHCH3
C2H5CH=CH2+CH2=CHCH3
现以烯烃C5H10为原料,合成有机物M和N,合成路线如下:

(1)按系统命名法,有机物A的名称是_______。
(2)B的结构简式是__________。
(3)C![]() D的反应类型是___________。
D的反应类型是___________。
(4)写出D![]() M的化学方程式________。
M的化学方程式________。
(5)已知X的苯环上只有一个取代基,且取代基无甲基,则N的结构简式为_______。
(6)满足下列条件的X的同分异构体共有_______种,写出任意一种的结构简式_________。
①遇FeCl3溶液显紫色 ②苯环上的一氯取代物只有两种
(7)写出E![]() F合成路线(用结构简式表示有机物,箭头上注明试剂和反应条件)。______
F合成路线(用结构简式表示有机物,箭头上注明试剂和反应条件)。______
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com