
科目: 来源: 题型:
【题目】有机化合物G是一种治疗胃及十二指肠溃疡、反流性或糜烂性食管炎等的药物,G 的一种合成路线如下:
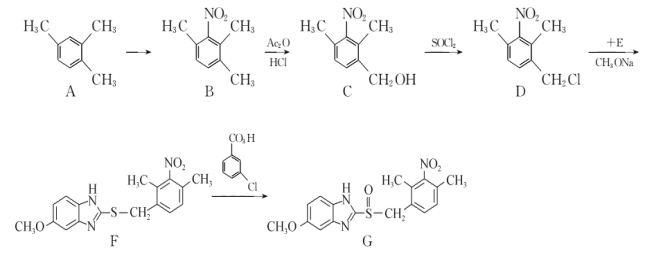
回答下列问题:
(1)A的化学名称为____________,C中所含官能团名称为____________。
(2)C生成D的反应类型为____________,F生成G的反应类型为____________。
(3)由A生成B的化学方程为____________。
(4)E的分子式为C8H8ON2S,其结构简式为____________。
(5)芳香化合物W是C的同分异构体。满足下列条件的W共有_________种(不含立体异构)。
①W分子中含氨基、羧基和羟基三种官能团
②苯环上只有两个取代基
③能与FeCl3溶液发生显色反应
其中核磁共振氢谱显示有6种不同化学环境的氢的结构简式为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、钴(Co)属于第四周期第VIII族元素,含铁、钴化合物具有诸多用途。回答下列问题:
(1)基态Co原子价层电子的电子排布图(轨道表达式)为________________。
(2)Co的配合物[Co(NH3)5Cl]SO4是一种重要的化合物。
①SO42-的空间立体构型为___________,其中S原子的杂化轨道类型是___________,写出一种与SO42-互为等电子体的分子的化学式:______________。
②[Co(NH3)5Cl]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为_______________。
③[Co(NH3)5Cl]SO4中,存在___________(填字母)
a.离子键 b.金属键 c.配位键 d.非极性键 e.极性键
(3)铁氰化钾{K3 [Fe(CN)6]}溶液是检验Fe2+常用的试剂。
①1mol [Fe(CN)6]3-含![]() 键的数目为__________。
键的数目为__________。
②CN-能与多种离子形成配合物,碳原子提供孤电子对,而不是氮原子,其原因是____________。
③FeS2晶体的晶胞如图所示。晶胞边长为a nm、FeS2相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______gcm-3;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为_________nm。
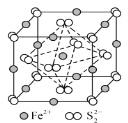
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯是重要的有机化工原料,可由乙醇脱水制备。涉及反应如下:
①2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
②2CH3OH(g)![]() C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
③CH3CH2OH(g)![]() CH3OCH3(g) △H3= +50.7kJmol-1
CH3OCH3(g) △H3= +50.7kJmol-1
④C2H5OH(g)![]() C2H4(g)+ H2O(g) △H4=akJmol-1
C2H4(g)+ H2O(g) △H4=akJmol-1
回答下列问题:
(1)a=___________。
(2)在1.0L密闭容器中放入0.10 mol C2H5OH(g),在一定温度下进行④反应,反应时间(t)与容器内气体总压强(P)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强P/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
①欲提高C2H5OH的平衡转化率,应采取的措施为___________(填字母)。
a.升高温度 b.增大压强
c.通入乙醇 d.降低压强
②由总压强P和起始压强P0计算反应物C2H5OH的转化率(C2H5OH)的表达式为_________,平衡时C2H5OH的转化率为_______(结果保留两位有效数字,下同),该反应的平衡常数K=_________。
③用总压强P和起始压强P0表示反应体系的总物质的量n(总)和反应物C2H5OH的物 质的量n(C2H5OH),n(总)=_____mol,n(C2H5OH)=_____mol。
(3)下表为反应④中反应物浓度与反应时间的数据,分析该反应中c(C2H5OH)变化与时间间隔(△t)的规律,得出的结论是______,由此规律推出反应在12h时c(C2H5OH)等于______molL-1
反应时间t/h | 0 | 4 | 8 | 16 |
c(C2H5OH)/(molL-1) | 0.10 | 0.051 | 0.026 | 0.0065 |
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示反应N2(g)+3H2(g) ![]() 2NH3(g)+92.2kJ。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )
2NH3(g)+92.2kJ。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )
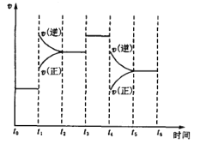
A.t0~t1B.t2~t3C.t3~t4D.t5~t6
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用 0. 100 mol L-1 的盐酸滴定 0.1 00 molL-1 的氨水,其滴定曲线如图所示:
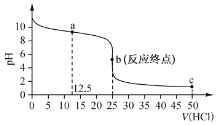
下列说法正确的是
A. 该滴定操作可用甲基橙作指示剂
B. a 点溶液中:c(NH4+)>c(NH3 H2O)>c(Cl- )
C. c 点溶液中:c(Cl-)>c(NH4+)>c(H+)
D. a→c过程中锥形瓶内水的电离度不断增大
查看答案和解析>>
科目: 来源: 题型:
【题目】电化学在日常生活中用途广泛,图甲是原电池,电池总反应为Mg+ClO-+H2O=Cl-+ Mg(OH)2,图乙是电解池,用于含Cr2O72-的工业废水的处理。下列说法错误的是
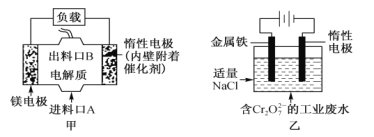
A. 图甲中发生的氧化反应是Mg—2e-=Mg2+
B. 图乙中惰性电极作电解池的阴极,电极棒上有H2放出
C. 图乙中Cr2O72-向惰性电极移动,该极附近有Cr(OH)3生成
D. 若图甲作为图乙的电源,当消耗3.6g镁时,理论上也消耗8.4g铁
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 硫酸铝溶液中加入过量的氨水:A13++4NH3H2O=A1O2-+4NH4+
B. 稀硝酸中加入过量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O
C. 浓盐酸与二氧化锰混合加热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D. 石灰水中加入过量小苏打溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷与氧气反应过程中的能量变化如下图所示。下列有关说法中正确的是
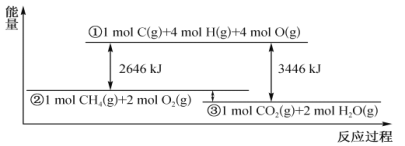
A. 反应 CO2(g)+2H2O(l)==CH4(g)+2O2(g) △H<0
B. 若将1mol CO2(g)、2 molH2O(l)的能量标在图中,则其位置在①、②之间
C. 若C一H键的键能为415kJ mol-1,则O= O的键能为493 kJ mol-1
D. 若该反应过程中转化的化学能为200kJ,则有0.25 molC=O生成
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中,反应aA (气) ![]() bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了B.物质A的转化率减少了
C.物质A的质量分数增加了D.a>b
查看答案和解析>>
科目: 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
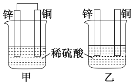
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的c(H+)均减小
D.产生气泡的速率甲比乙慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com