
科目: 来源: 题型:
【题目】Ⅰ、氯化亚铜(CuCl)难溶于水,常用作催化剂、气体吸收剂及脱氯剂等。
(1)向一定比例的CuSO4、NaCl溶液中持续加入一定浓度的Na2SO3溶液可制得CuCl。加入的Na2SO3溶液体积与溶液pH关系如图所示。

① 0 ~ 600 mL时pH降低的原因是_______(用离子方程式表示);
② 600 ~ 2000 mL的过程中有刺激性气味的气体产生,该气体是__________。
(2)CuCl的另一种制备原理是Cu2++Cu+2Cl-=2CuCl K=5.85×106,向0.01 molL-1的CuCl2溶液中加入足量的铜,写出计算过程说明能否生成CuCl: ________。
(3)使用CuCl捕捉CO气体的反应为CuCl(s) + xCO(g) ![]() CuClxCO(s) △H < 0,为提高CO的平衡转化率,可采取的措施有____(填标号)。
CuClxCO(s) △H < 0,为提高CO的平衡转化率,可采取的措施有____(填标号)。
A.降低温度 B.增大压强
C.延长反应时间 D.把CuCl分散到疏松多孔的分子筛中
Ⅱ、钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
上述盐溶液中的阴离子,结合氢离子能力最强的是__________ ;根据表中数据,下列三种酸的溶液分别稀释100倍,pH变化最大的是(填序号)___________
A. HClO B.H2CO3 C. CH3COOH
(2)次氯酸钠是一种 ______(填“强”或“弱”)电解质。某小组同学探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。打开活塞向烧瓶中的NaClO加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。出现上述现象的原因是______(请用反应的离子方程式表示)。
(3)实验室中常用氢氧化钠来进行洗气和提纯。
当150mL 1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室所用少量氯气是用下列方法制取的:4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O,试回答下列问题:
Cl2↑+MnCl2+2H2O,试回答下列问题:
(1)该反应中氧化剂与还原剂的物质的量比为:__。
(2)写出该反应的离子方程式:___。
(3)当有0.2mol电子转移时,生成标准状况下Cl2的体积是___L。
(4)若用足量二氧化锰与50ml36.5%1.2g/ml浓盐酸反应,制得的Cl2在标准状况下总小于3.36L,原因可能是①__,②__。
(5)检验氯气是否收集满的方法是用___试纸靠近集气瓶口,若试纸变蓝证明氯气已收集满。
查看答案和解析>>
科目: 来源: 题型:
【题目】NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。下列说法正确的是( )

A.O2在石墨Ⅱ附近发生氧化反应
B.该电池放电时NO3-向石墨Ⅱ电极迁移
C.石墨Ⅰ附近发生的反应:3NO2 +2e-=NO+ 2NO3-
D.相同条件下,放电过程中消耗的NO2和O2的体积比为4∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体。以A和B为原料合成扁桃酸衍生物F的路线如下:
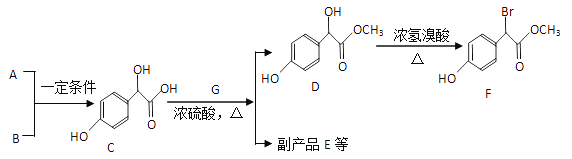
(1) A的分子式为C2H2O3,可发生银镜反应,且具有酸性,写出A+B→C的化学反应方程式:________
(2)C(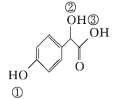 )中①、②、③3个—OH的酸性由强到弱的顺序是______
)中①、②、③3个—OH的酸性由强到弱的顺序是______
(3)E是由2分子C生成的含有3个六元环的化合物,E分子中不同化学环境的氢原子有____种
(4)D→F的反应类型是________,1 mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为____mol,写出符合下列条件的F的同分异构体2种(不考虑立体异构)的结构简式:_____
①属于一元酸类化合物
②苯环上只有2个取代基且处于对位,其中一个是羟基
(5)已知:
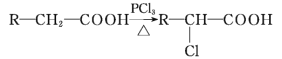
A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选) ______________(合成路线流程图示例如下:
H2C![]() CH2
CH2![]() CH3CH2OH
CH3CH2OH![]() CH3COOC2H5
CH3COOC2H5
查看答案和解析>>
科目: 来源: 题型:
【题目】CPAE是蜂胶的主要活性成分,也可由咖啡酸合成

下列说法不正确的是
A.咖啡酸分子中所有原子可能处在同一个平面上
B.可用金属Na检测上述反应是否残留苯乙醇
C.1 mol 苯乙醇在O2中完全燃烧,需消耗10 mol O2
D.1 mol CPAE与足量的NaOH溶液反应,最多消耗3 mol NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是( )
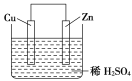
①Zn为正极,Cu为负极
②H+向正极移动
③电子流动方向,从Zn经外电路流向Cu
④Cu极上有H2产生
⑤若有1mol电子流过导线,则产生H2为0.5mol
⑥正极的电极反应式为:Zn-2e-=Zn2+
A.①②③⑤B.②③④⑤C.②④⑤⑥D.①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是
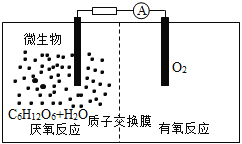
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有___,加MgO后过滤所得滤渣的主要成分为___。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?答:___。
(3)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①___;②___;③___;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10 mL于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式:___
②产品中Mg(ClO3)2·6H2O的质量分数为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为________
(2)NiO、FeO的晶体结构类型均与氯化钠的相同、Fe2+和Ni2+的离子半径分别78pm和69pm,则熔点FeO________ (填“<”或“>”) NiO;
(3)[Ni(NH3)6]SO4中阴离子的立体构型是_____。氨的沸点____(填“高于”或“低于”)膦(PH3),原因是_________;
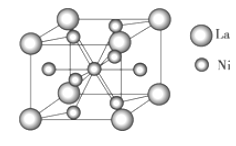
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。该合金的化学式为________;
(5)某镍白铜合金的立方晶胞结构如图所示。
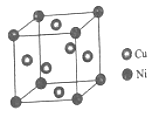
①晶胞中镍原子的堆积模型名称是_____。
②元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______
③若合金的密度为dg/cm3,晶胞参数(即边长)a =________nm
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、晶体硅(熔点1410℃)是良好的半导体材料,由粗硅制纯硅过程如下:
![]()
在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:_________。
Ⅱ、目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25 mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O(g)的浓度随时间变化如下图所示:
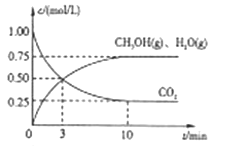
(1)从反应开始到平衡,氢气的平均反应速率υ(H2)=__________ 。
(2)该条件下CO2的转化率为_______。
Ⅲ、下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:

(1)M极的电极材料为 ___________________。
(2)加入乙醇的铂电极的电极反应式为___________。
(3)在此过程中乙池中某一电极析出金属银4.32g时,此时乙池溶液的体积为400mL,则乙池中溶液的pH为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com