
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是
A.2.1gDTO中含有的质子数为NA
B.30g葡萄糖和冰醋酸的混合物中含有的氢原子数为4NA
C.12g石墨烯(单层石墨)中含有六元环的个数为2NA
D.1mol铁在一定条件下分别和氧气、氯气、硫完全反应转移电子数都为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】NaClO2可用来漂白织物,其生产工艺如下图,回答下列问题:
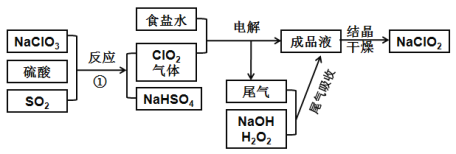
(1)图中两种氯的含氧酸盐中氯元素的化合价从高到低为____价、____价
(2)电解步骤所用食盐水由粗盐水精制而成,除去粗盐水中Mg2+、Ca2+,应加入的试剂分别为____、____
(3)写出反应①的化学方程式:__________
(4)“有效氯含量”是指每克含氯消毒剂的能力相当于多少克Cl2的氧化能力。则NaClO2的有效氯含量为:_______(计算结果保留两位小数)
查看答案和解析>>
科目: 来源: 题型:
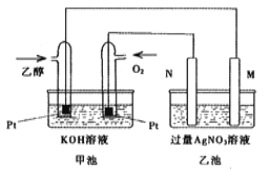
【题目】在298 K时,1 mol C2H5OH在氧气中完全燃烧生成二氧化碳和液态水放出热量1366.8 kJ。
(1)写出该反应的热化学方程式:________________________________________。
(2)如图将此反应设计为原电池,乙池中的两个电极一个是石墨电极,一个是铁电极。工作时M、N两个电极的质量都不减少,乙池中总反应的化学方程式为:_________________,一段时间后,测得乙池中某一电极质量增加4.32g时,理论上甲池消耗氧气体积为(标准状况)__________mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中的Ⅰ是某抗肿瘤药物的中间体,B的核磁共振氢谱有3组峰,C的分子式为C7H8O,D分子中有两个相同且处于相邻位置的含氧官能团,E的相对分子质量比D大34.5。
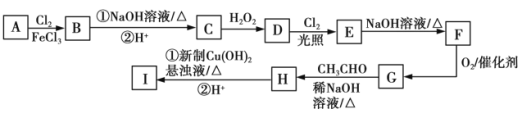
已知:RCHO+R1CH2CHO![]() RCH=C(R1)CHO+H2O。
RCH=C(R1)CHO+H2O。
请回答下列问题:
(1)C的名称是______,B的结构简式为_________,D转化为E的反应类型是____________。
(2)I中官能团的名称为______,I的分子式为________。
(3)写出E转化为F的化学方程式____________。
(4)X是G酸化后的产物,X有多种芳香族同分异构体,符合下列条件且能发生银镜反应的同分异构体有____种(不包括X),写出核磁共振氢谱有4组峰的物质的结构简式____________。
①遇FeCl3溶液发生显色反应 ②苯环上有两种类型的取代基
(5)参照上述流程,以乙醇为原料(其他无机试剂自选)可制取2﹣丁烯酸,写出相应的合成路线__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜与稀硫酸不反应,某校实验小组的同学在老师的指导下设计了下列装置,实现了铜与稀硫酸的反应。请回答下列问题:

(1)甲同学认为,不通入空气,将K与______(填“a”或“b”)连接,即可实现。则Cu极的电极反应式为________________________,总反应的离子方程式为________________________。
(2)乙同学认为在通入空气的同时,将开关K与____(填“a”或“b”)连接,也可以实现。电池总反应的化学方程式为_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】废旧锌锰电池含有锌、锰元素,主要含有ZnO、ZnMn2 O4、MnO、Mn2 O3、Mn3 O4、MnO2。利用废旧锌锰电池回收锌和制备二氧化锰、硫酸的工艺流程如图:
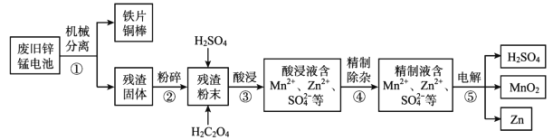
回答下列问题:
(1)步骤②“粉碎”的主要目的是______。
(2)步骤③“酸浸”发生了一系列反应:
ZnO+ H2SO4= ZnSO4 + H2O;MnO+ H2SO4= MnSO4 + H2O;
ZnMn2O4+2H2SO4=ZnSO4 + MnSO4 +2H2O+MnO2;
MnO2 + H2SO4 + H2C2O4=MnSO4 + 2CO2 ↑+2H2O。
推测 Mn2O3 与硫酸反应的离子方程式为______。
(3)如图分别表示“酸浸”时选用不同浓度硫酸和草酸对 Zn、Mn 浸出率的影响。
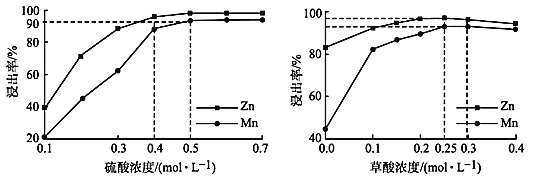
①为保证 Zn、Mn 的浸出率均大于 90%,步骤③需控制的 c(H2SO4) = ____mol/L。H2C2O4 浓度对 Mn 的浸出率影响程度大于 Zn,其原因是_____。
②假设“酸浸”所得溶液中Zn2+、Mn2+浓度相等。当 c(H2C2O4)>0.25 mol/L 时,Zn、Mn 的浸出率反而下降、且Zn 的浸出率下降先于Mn,其原因可能是_____(填序号)。
a.随着反应进行 c(H+)降低
b.Zn2+、Mn2+与 C2O42- 生成沉淀
c.溶解度:ZnC2O4<MnC2O4
(4)步骤⑤用惰性电极电解 ZnSO4 、MnSO4 的混合溶液,除生成 Zn、MnO2、H2SO4 外, 还可能生成 H2、O2 或其混合物。
①生成 MnO2 的电极反应式为_____ 。
②若 n (H2) :n (O2)=2:1,则参加反应的 n (Zn2+):n (Mn2+) = ______。
③该工艺流程中可循环利用的物质是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】“神舟七号”成功登天标志着我国的航天事业进入了新的篇章。
(1)某空间站局部能量转化系统如下图所示,其中燃料电池采用KOH溶液为电解液,燃料电池放电时的负极反应式为___________________________________。如果某段时间内氢氧储罐中共收集到33.6 L(已折算成标况)气体,则该段时间内水电解系统中转移电子的物质 的量为_________mol。

(2)在载人航天器的生态系统中,不仅要求分离出CO2,还要求提供充足的O2。某种电化学装置可实现转化2CO2 =2CO+O2,CO可用作燃料。已知该反应的阳极反应式为4OH--4e-=O2↑+2H2O,则阴极反应式为________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,将3molA和1molB两种气体混合于容积为2L的恒容密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2min末该反应达到平衡,测得生成0.8molD和0.4molC。下列判断正确的是( )
xC(g)+2D(g)。2min末该反应达到平衡,测得生成0.8molD和0.4molC。下列判断正确的是( )
A.x=2
B.2min时,A的浓度为0.9mol·L-1
C.2min内B的平均反应速率为0.3mol·L-1·min-1
D.B的转化率为60%
查看答案和解析>>
科目: 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述不正确的是( )
4NO(g)+6H2O(g),下列叙述不正确的是( )
①平衡时,υ正(O2)=υ逆(O2)必成立
②关系式5υ正(O2)=4υ逆(NO)总成立
③用上述四种物质NH3、O2、NO、H2O表示正反应速率的数值中,υ正(H2O)最大
④若投入4molNH3和5molO2,通过控制外界条件,必能生成4molNO
A.①②B.②③C.①③D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法不正确的是( )
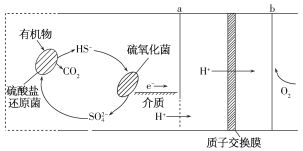
A.电子从a流出,经外电路流向b
B.HS-在硫氧化菌作用下转化为SO42-的反应是HS-+4H2O-8e-= SO42- +9H+
C.如果将反应物直接燃烧,能量的利用率不会变化
D.若该电池电路中有0.4mol电子发生转移,则有0.4molH+通过质子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com