
科目: 来源: 题型:
【题目】合成药物盐酸普罗帕酮的中间体E和双酚A型聚碳酸酯H的路线:
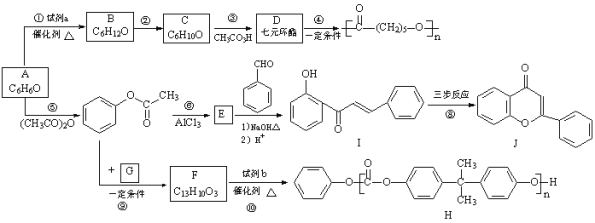
已知:i.![]()
ii.![]()
(1)A的结构简式是__________。
(2)试剂a是__________。
(3)C只含有一种官能团,反应②的化学方程式是__________。
(4)反应⑤的反应类型是__________。
(5)E中官能团是__________。
(6)下列说法正确的是:__________(填字母序号)。
a.反应③中C发生氧化反应
b.可用FeCl3溶液检验反应⑤中A是否反应完全
c.反应⑥的反应物与生成物互为同分异构体
d.反应⑩中试剂b的结构简式是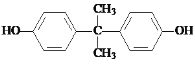
e.反应④是缩合聚合反应,生成了聚酯
(7)I→J转化的一种路线如图,已知中间产物2转化为J是消去反应,写出中间产物1和中间产物2的结构简式。
![]()
中间产物1:__________;中间产物2:__________。
(8)G的分子式为C3H6O3,只含一种官能团,且核磁共振氢谱只有一种化学环境的氢,反应⑨的化学方程式是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】含铬(Ⅵ)废水能诱发致癌,对人类和自然环境有严重的破坏作用。利用Cu2O光催化可以处理含有Cr2O72-的废水。
Ⅰ.制取Cu2O
(1)电解法:利用铜和钛做电极,电解含有NaCl和NaOH的溶液时,反应只消耗了铜和水,体系pH及Cl-浓度维持不变(溶液体积变化忽略不计)。阳极电极反应式是_______。
(2)还原法:控制100℃、pH=5的条件时,利用亚硫酸钠与硫酸铜溶液反应可以制得Cu2O,同时产生SO2气体。反应过程中需要不断地加入烧碱,其原因是_______。
Ⅱ.利用Cu2O光催化处理含Cr2O72-的废水的研究。
(1)光照射到Cu2O光催化剂上产生光催化反应,Cr2O72-和H2O分别在光催化反应中形成的微电极上发生电极反应,反应原理如图所示。写出Cr2O72-转化Cr3+的电极反应:_______。
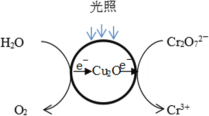
(2)研究中对Cu2O的作用提出两种假设:
a.Cu2O作光催化剂;b.Cu2O与Cr2O72-发生氧化还原反应。
已知:Cu2O的添加量是2×10-4mol/L,Cr2O72-的初始浓度是1×10-3mol/L;对比实验(pH=3.0且其他条件相同),反应1.5小时结果如图所示。结合试剂用量数据和实验结果可得到的结论是_______,依据是_______。

(3)溶液的pH对Cr2O72-降解率的影响如图所示。
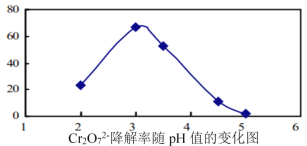
已知:Cu2O![]() Cu+CuSO4;酸性越大,Cr2O72-被还原率越大。
Cu+CuSO4;酸性越大,Cr2O72-被还原率越大。
①pH分别为2、3、4时,Cr2O72-的降解率最好的是___________,其原因是___________。
②已知pH=5时,会产生Cr(OH)3沉淀。pH=5时,Cr2O72-的降解率低的原因是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在2 L的恒容密闭容器中发生反应![]() 。反应过程中的部分数据如下表所示:
。反应过程中的部分数据如下表所示:
n/mol t/min |
|
|
|
0 | 2.0 | 2.4 | 0 |
5 | 0.9 | ||
10 | 1.6 | ||
15 | 1.6 |
下列说法正确的是( )
A.0~5 min用A表示的平均反应速率为![]()
B.该反应在10 min后才达到平衡
C.平衡状态时,![]()
D.物质B的平衡转化率为20%
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,可逆反应C(s)+CO2(g)![]() 2CO(g),达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是( )
2CO(g),达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是( )
A.①②③④B.①③
C.④②D.①③④
查看答案和解析>>
科目: 来源: 题型:
【题目】用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )

A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)如图的氮循环是生态系统物质循环的重要部分,人类活动加剧了氮循环中的物质转化。
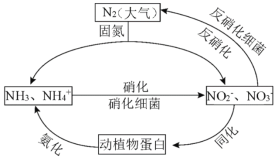
①下列说法正确的是_______(填字母序号)
A.固氮过程中,N2只做氧化剂
B.硝化过程需要有氧化剂参与
C.反硝化过程有助于弥补人工固氮对氮循环造成的影响
D.同化、氨化过程中,实现了氮元素在无机物和有机物之间的转化
②反硝化过程中,CH3OH可作为反应的还原剂,1mol还原剂失去6mol电子。请将该反应的离子方程式补充完整:5CH3OH+□NO3—![]() □_______+□_______+□_______+□_______,_____________
□_______+□_______+□_______+□_______,_____________
(2)研究表明,氮氧化物(NOx)和二氧化硫都与大气中雾霾的形成有关。
①已知:SO2生成SO3总反应方程式是2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-196.6kJ/mol
2SO3(g)ΔH=-196.6kJ/mol
此反应可通过如下两步完成:2NO(g)+O2(g)![]() 2NO2(g)ΔH1=-113kJ/mol
2NO2(g)ΔH1=-113kJ/mol
NO2(g)+SO2(g)![]() SO3(g)+NO(g)ΔH2=_______。
SO3(g)+NO(g)ΔH2=_______。
②一定温度下,向2L恒容密闭容器中充入NO2和SO2各1mol,5min达到平衡,此时容器中NO2和NO的浓度之比为1∶3,则NO2的平衡转化率是_______。
(3)砷(As)是第四周期ⅤA族元素,其化合物,有着广泛的用途。
①AsH3的稳定性比NH3的稳定性_______(填“强’’或“弱’’)。用原子结构解释原因_______。
②常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_______。
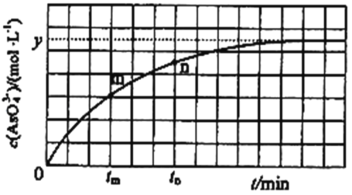
③298K时,将20mL3xmolL-1Na3AsO3、20mL3xmolL-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43﹣)与反应时间(t)的关系如图所示。若平衡时溶液的pH=14,则该反应的平衡常数K为_______。
AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43﹣)与反应时间(t)的关系如图所示。若平衡时溶液的pH=14,则该反应的平衡常数K为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法不正确的是(阿伏伽德罗常数为NA)( )
A.氯气跟水反应的离子方程式:Cl2+H2O=2H++Cl-+ClO-
B.15.6克Na2O2中所含的离子总数为0.6NA
C.11克D218O中含有的中子数为6NA
D.![]() 和
和![]() 质子数相同,但属于不同种核素
质子数相同,但属于不同种核素
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)向0.01 mol/L的NH4Cl溶液中分别加入少量的KOH固体、浓盐酸、FeCl3固体、Na2CO3固体,使NH4+水解平衡移动的方向分别为_____、_____、_____、____(填“右”“左”或“不移动”)
(2)写出Na2CO3溶液中的三大守恒规律
电荷守恒:_____________________;
物料守恒:_____________________;
质子守恒:_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】生产和实验中广泛采用甲醛法测定饱和食盐水样品中的NH4+含量。利用的反应原理为:4NH4++6HCHO=(CH2)6N4H+(一元酸)+3H++6H2O。实验步骤如下:
①甲醛中常含有微量甲酸,应先除去。取甲醛amL于锥形瓶,加入1~2滴指示剂,用浓度为bmol/L的NaOH溶液滴定,滴定管的初始读数为V1mL,当锥形瓶内溶液呈微红色时,滴定管的读数为V2mL。
②向锥形瓶加入饱和食盐水试样cmL,静置1分钟。
③用上述滴定管中剩余的NaOH溶液继续滴定锥形瓶内溶液,至溶液呈微红色时,滴定管的读数为V3mL。
下列说法不正确的是
A.步骤①中的指示剂可以选用酚酞试液
B.步骤②中静置的目的是为了使NH4+和HCHO完全反应
C.步骤②若不静置会导致测定结果偏高
D.饱和食盐水中的c(NH4+)=![]() mol/L
mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() —NMR(核磁共振)、
—NMR(核磁共振)、![]() —NMR可用于测定蛋白质、核酸等生物大分子的空间结构,瑞士科学家库尔特、维特里希等人为此获得诺贝尔化学奖。下列有关
—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,瑞士科学家库尔特、维特里希等人为此获得诺贝尔化学奖。下列有关![]() 、
、![]() 的叙述正确的是( )
的叙述正确的是( )
A. ![]() 与
与![]() 互为同位素B.
互为同位素B. ![]() 与C60互为同素异形体
与C60互为同素异形体
C. ![]() 、
、![]() 具有相同的中子数D.
具有相同的中子数D. ![]() 的核外电子数与中子数相同
的核外电子数与中子数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com