
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.向溴化亚铁溶液中通入过量氯气Fe2++2Br-+2Cl2=Fe3++Br2+4Cl-
B.三氯化铁溶液跟过量氨水反应Fe3++3NH3H2O=Fe(OH)3↓+3NH![]()
C.硫化亚铁与盐酸反应S2-+2H+=H2S↑
D.过量铁粉与稀HNO3反应Fe+4H++NO![]() =Fe3++NO↑+2H2O
=Fe3++NO↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol—OH(羟基)与l mol![]() 中所含电子数均为10NA
中所含电子数均为10NA
B.常温常压下,水蒸气通过过量的Na2O2使其增重2 g时,反应中转移的电子数为NA
C.0.lmol苯与足量氢气反应后,破坏碳碳双键的数目为0.3NA
D.10g KHCO3和CaCO3的固体混合物中含有的![]() 数目为0.1NA
数目为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理"的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的核外电子排布式是[Ar]_____________,基态Ga原子核外电子占据最高能级的电子云轮廓图为___________。
(2)硒的含氧酸有H2SeO3,H2SeO4。酸性:H2SeO3____________H2SeO4(填“>”“<”或“=”)。SeO32的空间构型是_____________________。
(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为_____________。写出和该阴离子互为等电子体的一种分子的结构式_______________。
(4)钙和铁都是第四周期元素,且原子的最外层电子数相同,铁的熔沸点远高于钙,其原因是_____。
(5)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN-的结构式可以表示为[S=C=N]-或[S-C≡N]-,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN-中提供孤电子对的原子可能是_______。
(6)某离子晶体XY2的晶胞结构如图所示。

①晶体中在每个X周围与它最近且距离相等的X共有_________个。
②设该晶体的摩尔质量为Mg·mol-1,晶胞的密度为ρg.cm-3,阿伏加德罗常数为NA,则晶体中两个最近的X间的距离为________cm。
查看答案和解析>>
科目: 来源: 题型:
【题目】酸碱质子理论认为:凡能给出质子的分子或离子都是酸,凡能结合质子的分子或离子都是碱。按照这个理论,下列属于两性物质的微粒是( )
①H2O ②CN- ③HS- ④CH3COOH ⑤H2PO![]() ⑥OH-
⑥OH-
A.①②⑤B.③④⑥C.①③⑤D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】七水合硫酸镍为水绿色斜方棱形晶体,有甜味,俗称“翠矾”。某学习小组用含镍催化剂废渣(主要成分是镍单质,含少量铁、铝单质及其氧化物,以及少量难溶性杂质),制备七水合硫酸镍晶体,流程图如下:
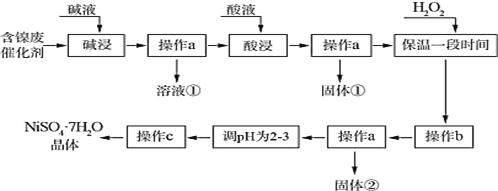
几种难溶碱开始沉淀和完全沉淀的 pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀 | 3.8 | 2.7 | 7.6 | 7.1 |
完全沉淀 | 5.2 | 3.2 | 9.7 | 9.2 |
回答下列问题:
(1)“碱浸”操作发生的离子方程式为____________。
(2)①“固体①”的主要成分是__________,双氧水作用为___________。
②如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是_______________________,设计实验证明产品中是否含“杂质”:____________。(不考虑硫酸镍影响)
(3) “操作 b”中调节溶液 pH 范围是_________,“操作 c”之前,“调节 pH 为 2~3”的目的是_______。
(4) “操作 c”具体是指___________________、过滤、洗涤、干燥。
(5)取 4.000 g 硫酸镍晶体产品(NiSO4·7H2O)于锥形瓶中,加入足量的去离子水溶解,用0.2000 mol·L-1 的标准溶液EDTA(Na2H2Y)滴定至终点(发生Ni2++ H2Y2- = NiY2-+ 2H+ ),三次实验消耗标准液的体积分别为 69.10 mL、68.90 mL、59.00 mL,则产品纯度为_________%。(计算结果保留到小数点后 2 位,不考虑杂质反应)。
查看答案和解析>>
科目: 来源: 题型:
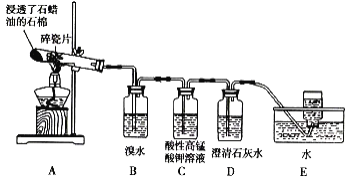
【题目】某同学设计实验探究工业制乙烯的原理和乙烯主要的化学性质,实验装置如图所示。
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热、加压条件下发生反应生成不饱和烃。已知烃类都不与碱反应。例如,石油分馏产物之一十六烷可发生如下反应,反应式已配平:C16H34![]() C8H18+甲,甲
C8H18+甲,甲![]() 4乙,则甲的分子式为______;乙的结构简式为____。
4乙,则甲的分子式为______;乙的结构简式为____。
(2)B装置中的实验现象是______。
(3)C装置中的实验现象是_____,其中发生反应的反应类型是___。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置_(填序号)中的实验现象可判断该资料是否真实。
(5)通过题述实验探究可知,检验甲烷和乙烯的方法是_____(填序号,下同);除去甲烷中乙烯的方法是____。
A.气体通入水中 B.气体通过装溴水的洗气瓶
C.气体通过装酸性高锰酸钾溶液的洗气瓶 D.气体通过氢氧化钠溶液
(6)分别燃烧乙烯和甲烷,乙烯产生黑烟,原因是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的HX、HY溶液,pH随NaOH溶液体积变化如图。下列结论正确的是( )
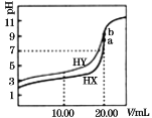
A.已知室温下某碱AOH的Kb=1×10-9,则AY的水溶液呈碱性
B.当加入10.00mL NaOH溶液时,有c(Na+)>c(HX)> c(X-)> c(H+)
C.pH=7时,c(Y-)=c(X-)
D.a、b两点溶液混合后,c(HX)+c(HY)+c(H+)=c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题:
(1)CH4超干重整CO2的催化转化如图所示:
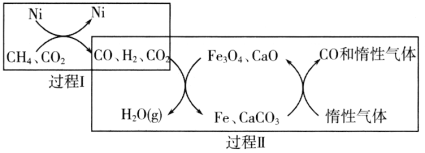
①已知相关反应的能量变化如图所示:

过程Ⅰ的热化学方程式为________。
②关于上述过程Ⅱ的说法不正确的是________(填序号)。
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
③其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应CH4(g)+CO2(g)=2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态________(填“是”或“不是”)平衡状态;b点CH4的转化率高于c点,原因是________。
(2)在一刚性密闭容器中,CH4和CO2的分压分别为20kPa、25kPa,加入Ni/α-Al2O3催化剂并加热至1123K使其发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g)。

①研究表明CO的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某时刻测得p(CO)=20kPa,则p(CO2)=________kPa,υ(CO)=________mol·g-1·s-1。
②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的计算式为Kp=________(kPa)2。(用各物质的分压代替物质的量浓度计算)
(3)CH4超干重整CO2得到的CO经偶联反应可制得草酸(H2C2O4)。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中![]() ,则此时溶液的pH=________。(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
,则此时溶液的pH=________。(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外活动小组拟用铅蓄电池为直流电源,进行电絮凝净水的实验探究,设计的实验装置如图所示,下列叙述正确的是( )

A.X电极质量减轻,Y电极质量增加
B.电解池阳极上被氧化的还原剂有Al和H2O
C.电解池的总反应为2Al+6H2O![]() 2Al(OH)3+3H2↑
2Al(OH)3+3H2↑
D.每消耗103.5gPb,理论上电解池阴极上有1molH2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com