
科目: 来源: 题型:
【题目】钠和钾是极活泼的金属元素,钠和钾及化合物在生产和生活中有广泛的应用。
(1)写出两种可以食用的含钠化合物的化学式:________。将0.01 mol下列物质(①Na2O2;②Na2O;③Na2CO3;④NaCl)分别加入100 mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度由大到小的顺序是(溶液体积变化忽略不计)_______。
(2)由于钾比钠更活泼,制备K2O一般是用单质钾还原对应的过氧化物、硝酸盐或亚硝酸盐,试写出用钾与硝酸钾反应制取K2O的化学方程式(还有一种单质生成):______________________。K2O2也有强氧化性,试写出其与SO2发生反应的化学方程式:_______________________。
(3)某学生用Na2CO3和 KHCO3组成的某混合物进行实验,测得如表数据(盐酸的物质的量浓度相等且不考虑HCl的挥发)
实验序号 | ① | ② | ③ | ④ |
盐酸体积/mL | 50 | 50 | 50 | 50 |
固体质量/g | 3.06 | 6.12 | 9.18 | 12.24 |
生成气体体积/L(标况) | 0.672 | 1.344 | 1.568 | 1.344 |
根据数据计算所用盐酸的物质的量浓度为__________,原混合物样品中n(Na2CO3)∶n(KHCO3)=_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知酸性K2Cr2O7溶液可与FeSO4溶液反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是
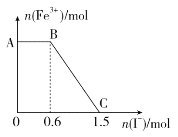
A. 图中AB段的氧化剂为K2Cr2O7
B. 开始加入的K2Cr2O7为0.25 mol
C. K2Cr2O7与FeSO4反应的物质的量之比为1∶3
D. 图中BC段发生的反应为2Fe3++2I-===2Fe2++I2
查看答案和解析>>
科目: 来源: 题型:
【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:
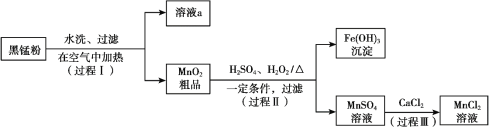
(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是_______。
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。
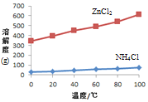
① 溶液a呈酸性,原因是______。
② 根据如图所示的溶解度曲线,将溶液a______(填操作),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ | ------------- |
根据上表,设计方案提纯NH4Cl:________。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入_______(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:________。
② 解释试剂加入顺序不同,MnO2作用不同的原因:________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
查看答案和解析>>
科目: 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO32-、SO42-、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
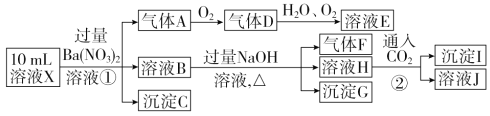
下列说法正确的是
A. X中一定存在Fe2+、Al3+、NH4+、SO42-
B. 溶液E和气体F能发生化学反应
C. X中肯定不存在CO32-、SO32-、Al3+
D. 沉淀I只有Al(OH)3
查看答案和解析>>
科目: 来源: 题型:
【题目】有关反应14CuSO4+5FeS2+12H2O===7Cu2S+5FeSO4+12H2SO4的下列说法中错误的是
A. CuSO4在反应中被还原
B. FeS2既是氧化剂也是还原剂
C. 14 mol CuSO4氧化了1 mol FeS2
D. 被还原的S和被氧化的S的质量之比为3∶7
查看答案和解析>>
科目: 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )
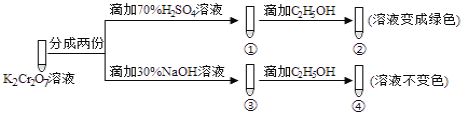
A.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
B.②中C2H5OH被Cr2O72-氧化成CH3COOH
C.对比②和④可知K2Cr2O7酸性溶液氧化性比K2CrO4溶液强
D.①中溶液橙色加深,③中溶液变黄
查看答案和解析>>
科目: 来源: 题型:
【题目】著名化学家徐光宪获得“国家最高科学技术奖”,以表彰他在稀土萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法不正确的是( )
A.铈(Ce)元素在自然界中主要以化合态形式存在
B.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+
D.四种稳定的核素![]() Ce、
Ce、![]() Ce、
Ce、![]() Ce、
Ce、![]() Ce,它们互称为同位素
Ce,它们互称为同位素
查看答案和解析>>
科目: 来源: 题型:
【题目】向某碳酸钠溶液中逐滴加1 mol·L-1的盐酸,测得溶液中Cl-、HCO3-的物质的量随加入盐酸体积的关系如图所示,其中n2∶n1=3∶2,则下列说法中正确的是

A. b点的数值为0.6
B. 该碳酸钠溶液中含有1 mol Na2CO3
C. b点时生成CO2的物质的量为0.3 mol
D. oa段反应的离子方程式与ab段反应的离子方程式相同
查看答案和解析>>
科目: 来源: 题型:
【题目】NaCl是我们生活中必不可少的物质。将NaCl溶于水配成1 mol·L-1的溶液,溶解过程如图所示,下列说法正确的是
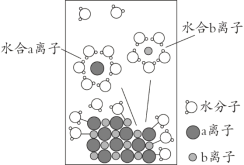
A. a离子为Na+
B. 溶液中含有NA个Na+
C. 水合b离子的图示不科学
D. 室温下测定该NaCl溶液的pH小于7,是由于Cl-水解导致
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
编号 | 电极材料 | 电解质溶液 | 电流表指针 |
1 | Mg、Al | 稀盐酸 | 偏转 |
2 | Al、Cu | 稀盐酸 | 偏转 |
3 | Al、C(石墨) | 稀盐酸 | 偏转 |
4 | Mg、Al | 氢氧化钠溶液 | 偏转 |
5 | Al、Zn | 浓硝酸 | 偏转 |
下列回答错误的是
A.实验1、2中铝所作的电极(正极或负极)不相同
B.实验2、3,铝电极的电极反应式均为Al-3e-=Al3+
C.实验4中铝电极的电极反应式为Al-3e-+4OH-=![]() +2H2O
+2H2O
D.实验5中铝始终作原电池的负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com