
科目: 来源: 题型:
【题目】某小组利用含铅废料(主要含PbO、PbSO4和PbO2)制备化工产品(PbSO4·3PbO·H2O)的工艺流程如图:

已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。请回答下列问题:
(1)“转化”时,加入Na2CO3的目的是将PbSO4转化成PbCO3,其转化原理是___________。PbO2转化为PbCO3的离子方程式为_________。
(2)该流程中可以循环利用的物质是_________,若其中残留过多SO42-,循环利用可能出现的问题是__________。
(3)一定浓度的硝酸溶解PbCO3和PbO时,“酸溶”时,金属离子浸出率与温度的关系如图所示。当温度为40℃,金属离子浸出率最高,其主要原因是________。

(4)取一定量的含铅废料经上述“转化”,假设含铅废料中的PbO2和PbSO4全部转化成PbCO3,且PbO未发生反应,“酸溶”时共收集到5.6 L CO2(标准状况),“沉铅”时得到121.2 g PbSO4。
①原含铅废料中含PbO的物质的量为__________。
②“合成”时,加入NaOH的质量为__________。
(5)工业上,电解Pb(NO3)2溶液制备活性电极材料PbO2,其阳极的电极反应式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温恒容容器中发生N2O4(g)2NO2(g),若反应物的浓度由0.1molL﹣1降到0.06molL﹣1需20s,那么由0.06molL﹣1降到0.036molL﹣1,所需反应时间为( )
A. 10 sB. 12 sC. 大于12 sD. 小于12 s
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,表中列出12种元素在周期表中的位置,按要求回答下列问题。
周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑥ | (11) | ⑧ | ⑩ | ||||
三 | ① | ③ | ⑤ | ⑦ | (12) | ⑨ | ||
四 | ② | ④ |
(1)在这12种元素中,化学性质最不活泼的元素名称是______,得电子能力最强的原子是_____(用元素符号表示);元素⑦的最高价氧化物对应的水化物是_____(写化学式)。
(2)
(3)①⑧⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示) ______。
(4)请写出:
(ⅰ) ③的单质置换出⑥的单质的化学方程式:_________________________。
(ⅱ) ⑤和(11)两种元素最高价氧化物对应的水化物相互反应的离子方程式为___________。
(ⅲ)元素⑨的单质和元素①的最高价氧化物对应的水化物常温下反应的化学方程式为__。
查看答案和解析>>
科目: 来源: 题型:
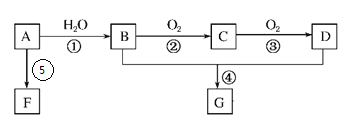
【题目】A的产量是衡量一个国家石油化工发展水平的标志。B和D是生活中两种常见的有机物,F是高分子化合物。相互转化关系如图所示:
已知:![]()
(1)A分子的结构简式为_____________;B中官能团名称为_____________。
(2)在反应①~⑤中,属于加成反应的是______,属于取代反应的是______(填序号)。
(3)写出下列反应的化学方程式:
④B+D→G:_______________________;
⑥A→F:__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(I)某温度时,在2 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题。
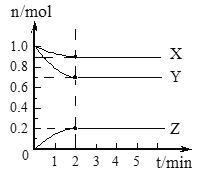
(1)列式计算反应开始至2 min,Y的平均反应速率___________。
(2)分析有关数据,写出X、Y、Z的反应方程式___________。
(3)由图中看出:________分钟后,A、B、C各物质的物质的量不再随时间而变化,说明在这个条件下,该反应已达到了________________状态。
(II)将纯锌片和纯铜片按如图所示方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
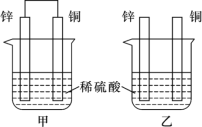
①下列说法正确的是____________(填字母代号)。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲____乙(填“>”、“<“或“=”)。
③请写出图中构成原电池的装置正极的电极反应式______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各项表述与示意图一致的是:

A.图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g) → CH3CH3(g)ΔH<0;使用和未使用催化剂时,反应过程中的能量变化
B.图②表示25 ℃时,用0.01 mol·L-1盐酸滴定一定体积的0.01 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
C.图③表示CH4(g)+H2O(g) ![]() CO(g)+3H2(g)ΔH,反应CH4的转化率与温度、压强的关系,且p1>p2,ΔH<0
CO(g)+3H2(g)ΔH,反应CH4的转化率与温度、压强的关系,且p1>p2,ΔH<0
D.图④ 中曲线表示反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH <0;正、逆反应的平衡常数K随温度的变化
2SO3(g) ΔH <0;正、逆反应的平衡常数K随温度的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】乙二醛(OHC-CHO)是一种重要的精细化工产品。某小组利用乙醛液相硝酸氧化法制备乙二醛并测定乙二醛纯度,装置如图所示:
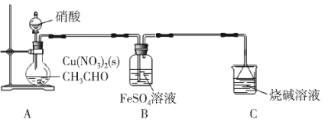
已知:①NO+FeSO4=FeSO4·NO(棕色)。
②几种有机物的部分性质如表所示:
乙醛 | 乙二醛 | 乙二酸 | 乙酸 | |
沸点/℃ | 20.8 | 50.5 | 109 | 117.9 |
溶解性 | 与水、有机溶剂互溶 | 溶于水、乙醇等 | 溶于水和有机溶剂 | 与水、乙醇互溶 |
密度/gcm-3 | 0.78 | 1.27 | 1.90 | 1.05 |
相对分子质量 | 44 | 58 | 90 | 60 |
实验步骤:
①取20 mL乙醛装于烧瓶,加入2 g Cu(NO3)2粉末作催化剂,向烧瓶中缓慢滴加2 mol·L-1硝酸至乙醛完全反应为止;
②提纯产品,最终得到10.0 mL产品。
请回答下列问题:
(1)盛装硝酸的仪器名称是___________。
(2)实验中,观察到装置B中溶液变为棕色,制备乙二醛的化学方程式为________________。
(3)向烧瓶中滴加硝酸要“缓慢”,其目的是___________;判断烧瓶中制备乙二醛的反应已完成的标志是___________。
(4)分离提纯产品,宜选择下列装置___________(填字母)。
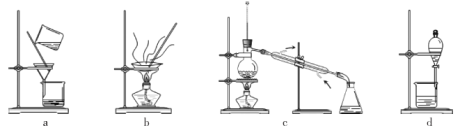
(5)根据上述实验数据,该实验中乙二醛的产率约为___________(填字母)。
a.56.5% b.61.8% c.67.9% d.72.6%
(6)实验室可用酸性KMnO4溶液测定乙二醛的纯度,发生反应的离子方程式为:18H++6MnO4-+5C2H2O2→10CO2↑+6Mn2++14H2O。实验步骤如下:取V mL产品,加蒸馏水稀释至250 mL,量取25.00 mL稀释后的溶液于锥形瓶,滴加5.00 mL稀硫酸,用c mol·L-1 KMnO4溶液,三次平行实验消耗KMnO4溶液体积如下:
实验 | Ⅰ | Ⅱ | Ⅲ |
V[KmnO4(aq)]/mL | 20.05 | 22.40 | 19.95 |
滴定终点的标志是___________;该产品纯度为___________g·mL-1(用含V和c的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,有体积均为20.00 mL、浓度均为0.1 mol·L-1的HX溶液和HY溶液,分别向其中滴加相同浓度的NaOH溶液,混合溶液pH与NaOH溶液体积的关系如图所示。下列说法不正确的是
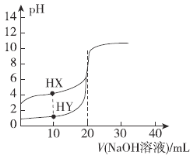
A.该滴定过程的指示剂为酚酞溶液
B.V=20.00 mL时,c(HX)+c(X-)=c(Y-)
C.pH=7时,两种溶液中c(X-)=c(Y-)
D.若HX溶液起始pH=3,则常温下HX的Ka≈1.0×10-5
查看答案和解析>>
科目: 来源: 题型:
【题目】用 0.50molL﹣1NaOH标准液10.00mL,将未知浓度的盐酸20.00mL恰好滴定至终点,下列说法正确的是( )
A. 若滴定完毕,滴定管尖嘴悬有一滴液体,则所测的盐酸浓度偏大
B. 用量筒量取上述盐酸
C. 若选用酚酞作指示剂,终点时,液体恰好褪色
D. 盐酸的浓度为1.00 molL﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组设计如图所示的装置进行原电池原理的探究。下列叙述错误的是

A.a和b不连接时,锌片上有气体生成,该装置不能形成原电池
B.a和b用导线连接时锌片为负极,发生的反应式为:Zn-2e-=Zn2+
C.a和b用导线连接时,电子由Zn经导线流向Cu,再经稀硫酸流回Zn
D.无论a和b是否连接,稀硫酸均参与反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com