
科目: 来源: 题型:
【题目】恒温恒容条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g),若将1 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数不可能为a的是
2NH3(g),若将1 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数不可能为a的是
A. 2 mol NH3B. 1 mol N2、3 mol H2和2 mol NH3
C. 0.5 mol N2、1.5 mol H2和1 mol NH3D. 0.1 mol N2、0.3 mol H2和1.8 mol NH3
查看答案和解析>>
科目: 来源: 题型:
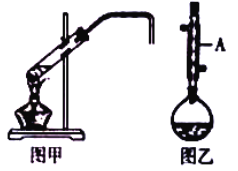
【题目】化学实验小组欲在实验室制备溴乙烷(图甲)和1﹣溴丁烷(图乙),涉及化学反应如下:
NaBr+H2SO4═HBr+NaHSO4 ①
C2H5﹣OH+HBrC2H5﹣Br+H2O ②
CH3CH2CH2CH2﹣OH+HBrCH3CH2CH2CH2﹣Br+H2O ③
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br﹣被浓硫酸氧化为Br2等。有关数据列表如下;
乙醇 | 溴乙烷 | 正丁醇 | 1﹣溴丁烷 | |
密度/gcm﹣3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 111.6 |
请回答下列问题:
(1)图乙中仪器A的名称为_____。
(2)乙醇的沸点高于溴乙烷的沸点,其原因是_____。
(3)将1﹣溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在_____(填“上层”、“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必需进行稀释,其目的是_____。(填字母)
A.减少副产物烯和醚的生成
B.减少Br2的生成
C.减少HBr的挥发
D.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是_____。(填字母)
A.NaIB.NaOHC.NaHSO3D.KCl
(6)制备溴乙烷(图甲)时,采用边反应边蒸出产物的方法,其有利于_____;但制备1﹣溴丁烷(图乙)时却不能边反应边蒸出产物,其原因是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】泉州6.97吨“碳九”产品泄漏入海,造成水体污染。“碳九”是在石油提炼时获得一系列含碳数量在9左右的碳氢化合物。“碳九”包括裂解碳九和重整碳九,后者中的芳香烃含量较高。下列有关说法不正确的是( )
A.若将“碳九”添加到汽油中,可能会使汽油燃烧不充分而形成积炭
B.石油最主要的用途是提炼汽油和柴油,“碳九”的沸点低于汽油和柴油
C.分子式为![]() ,且含有一个苯环的物质共有8种
,且含有一个苯环的物质共有8种
D.间三甲苯(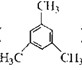 )分子中所有碳原子都在同一平面
)分子中所有碳原子都在同一平面
查看答案和解析>>
科目: 来源: 题型:
【题目】物质分离、提纯的常用装置如图所示,根据题意选择合适的装置填入相应位置。

(1)我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写到:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”所用的是__装置(填“甲”、“乙”、“丙”、“丁”或“戊”,下同)。
(2)《本草衍义》中对精制砒霜过程的叙述为:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下重如乳,尖长者为胜,平短者次之。”文中涉及的操作方法所用是_____装置。
(3)海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
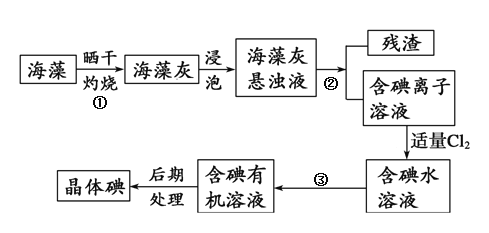
其中分离步骤①、②、③所用分别为:_____装置、_____装置、_____装置。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中氧化剂是________(填化学式),过氧化钠(Na2O2)中氧元素化合价为_____。(填数字)
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:_________________。
②每生成1mol FeO42-转移___mol电子,若反应过程中转移了0.3mol电子,则还原产物的物质的量为_____mol。
(3)配平下面化学方程式,回答下列问题:____C +K2Cr2O7+H2SO4=K2SO4+CO2↑+Cr2(SO4)3+H2O。
①H2SO4在上述反应中表现出来的性质是(填选项编号)______。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为_____L。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)顺铂(化学名称为顺二氯二氨合铂(II),化学式为PtCl2(NH3)2,相对分子质量为:300)是一种用于治疗癌症的药物,一片顺铂药片所含顺铂的质量为6×10-4g。那么一片顺铂药片中N原子的物质的量________;
(2)乙烯气体(C2H4)是石油化工产品之一,也是最重要的有机化工基础原料之一,在标准状况下其密度为_______g.L-1;(已知:标准状况下,Vm=22.4Lmol-1 )
(3)现有一种矿泉水样品,1.0升的该矿泉水含有4.8×10-2gMg2+。则________升矿泉水中含有1molMg2+;
(4)某“84消毒液”1000mL.其有效成分为NaClO(式量:74.5),质量分数为14.9%,密度为1.2g/L。其溶质的物质的量浓度为________;
(5)已知CO和CO2的混合气体7.2g。在标准状况下所占的体积为4.48L。则该混合气体中氧元素的质量为_______;
(6)如图所示两瓶体积相等的气体,在同温同压下,若瓶1两种气体______(填“物质的量”或者“质量”)相等,则两瓶中的气体原子总数和质量均相等。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验中,实验设计或所选装置合理的是( )
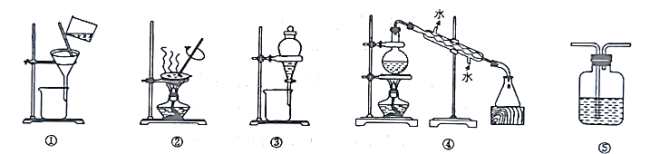
A.用乙醇提取碘水中的碘,应选择图③所示装置
B.用图①和图②所示装置进行粗盐提纯
C.用图④所示装置进行石油分馏实验制取汽油
D.图⑤所示装置中盛有饱和![]() 溶液,用于除去
溶液,用于除去![]() 中含有的少量
中含有的少量![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中,互为同位素的是_____,互为同素异形体的是_____,互为同系物的是_____,互为同分异构体的是_____,属于同一种物质的是_____。
①金刚石与石墨 ②12C与14C ③O2与O3 ④ ⑤
⑤ ⑥
⑥ 与
与 ⑦CH2=CHCH2OH与CH3COCH3 ⑧
⑦CH2=CHCH2OH与CH3COCH3 ⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】主族元素![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增加,且均不大于20。
的原子序数依次增加,且均不大于20。![]() 、
、![]() 、
、![]() 族序数之和为10;
族序数之和为10;![]() 的原子半径在同周期主族元素中最小;
的原子半径在同周期主族元素中最小;![]() 与
与![]() 形成的化合物常温下可与饱和
形成的化合物常温下可与饱和![]() 溶液反应,产生的气体常用于切割和焊接金属。下列说法错误的是( )
溶液反应,产生的气体常用于切割和焊接金属。下列说法错误的是( )
A.简单离子半径:![]()
B.![]() 的单质是人类将太阳能转化为电能的常用材料
的单质是人类将太阳能转化为电能的常用材料
C.![]() 与
与![]() 形成的化合物均满足8电子稳定结构
形成的化合物均满足8电子稳定结构
D.![]() 与
与![]() 形成的化合物与饱和
形成的化合物与饱和![]() 溶液的反应可选用启普发生器
溶液的反应可选用启普发生器
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com