
科目: 来源: 题型:
【题目】在乏燃料后处理流程中,四价铀作为铀钚分离的还原剂己广泛使用。在UO2(NO3)-2HNO3-N2H4。HNO3体系下采用电解法制备四价铀,电解总反应为2UO22++N2H5++3H+![]() 2U4++N2↑+4H2O,电解装置如图所示。下列说法正确的是
2U4++N2↑+4H2O,电解装置如图所示。下列说法正确的是
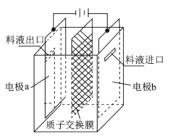
A.若转移4mol e-,将有4mol H+透过质子交换膜
B.b极的电极反应式为UO22++2H2O+2e-=U4++4OH-
C.电解液中NO3-的移动方向:a→质子交换膜→b
D.当产生11.2 mL N2时,同时生成U4+的质量为0.2389
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠广泛用于媒染剂、漂白剂等。某兴趣小组用下列装置制取较纯净的NaNO2。
甲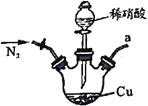 乙
乙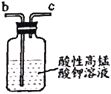 丙
丙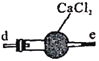 丁
丁![]()
反应原理为:2NO+Na2O2=2NaNO2。已知:NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。下列分析错误的是
A.甲中滴入稀硝酸前需通人N2
B.仪器的连接顺序为a-f-g-d-e-b
C.丙中CaCl2用于干燥NO
D.乙中吸收尾气时发生的离子反应为3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:① Fe + H2SO4(稀) ![]() FeSO4 + H2↑
FeSO4 + H2↑
② CuO + H2 ![]() Cu + H2O
Cu + H2O
③ MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
试回答下列问题:
(1)反应①中_________作氧化剂(填化学式),___________是氧化产物(填化学式);若有2mol Fe完全反应,转移的电子数为________ mol。
(2)用双线桥法表示反应②电子转移的方向和数目:________
(3)反应③中HCl体现了_________________性和_______________性
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)5.4 g H2O的物质的量是_____,含有_________个水分子(用NA表示),含有____mol H。
(2)11.2L NH3(标况)约含_____ mol氢原子,_____ g的氮原子。
(3)6.02×1022个OH 的质量为____,含有质子的物质的量为_____,含有电子的物质的量为__ 。
(4)12.4 g Na2R含Na+0.4 mol,则Na2R的摩尔质量为_______,R的相对原子质量为_______。含R的质量为1.6 g的Na2R,其物质的量为________。
(5)物质的量相同的CO2和O2,其所含原子数目之比为_____,所含氧原子数目之比为______;质量相同的CO2和O2,其物质的量之比为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要0.1 molL1NaOH溶液500mL和0.5 molL1硫酸溶液480mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器有玻璃棒和______(填仪器名称)。
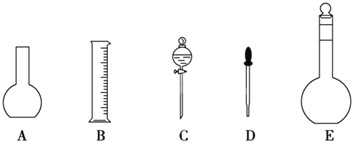
(2)容量瓶使用前必须进行的一步操作是___________。
(3)根据计算,该实验用托盘天平称取NaOH的质量为______g。在实验中其他操作均正确,若称量NaOH溶液时砝码生锈,则所得溶液浓度______0.1molL1(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度______0.1molL1。
(4)在配制稀H2SO4的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)?
①未经冷却趁热将溶液注入容量瓶中:___________。
②定容时仰视观察液面:___________。
③用量筒量取浓硫酸时俯视:______________。
(5)在实验过程中出现如下情况应如何处理?
加蒸馏水时不慎超过了刻度,应_________;加蒸馏水到刻度下1cm ~ 2 cm处应__________滴加至凹液面最低处与刻度线相切;移液时不慎将少量液滴滴在容量瓶外面,应_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是盛放液溴的试剂瓶剖面图,仔细观察分成了明显的气相、溴溶液相和液溴相三相,下列说法错误的是( )
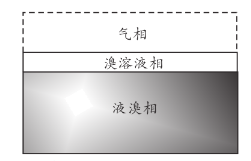
A.气相呈现红棕色,因为其中含有Br2的蒸汽
B.溴溶液相中显酸性,主要因为HBr电离出了H![]()
C.液溴保存时加水形成水封的目的是减少Br2的挥发
D.液溴保存时不可敞口放置,应保存在细口瓶中并塞上橡胶塞
查看答案和解析>>
科目: 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为:S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列说法中正确的是( )
K2S+N2↑+3CO2↑,下列说法中正确的是( )
A.该反应中的还原剂为KNO3
B.该反应中C被还原
C.若消耗32g S,该反应转移电子数为4 NA
D.若生成标准状况下气体22.4L,则有0.75 mol物质被还原
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)。
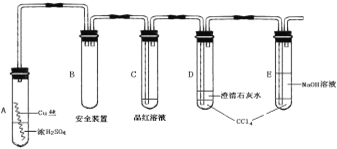
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
以下是该学习小组部分交流记录及后续探究实验的记录:
材料一:小组交流摘录
学生1:加热前,无现象发生;加热后,液面下铜丝变黑,产生气泡,有细小黑色颗粒状物质从铜丝表面进入浓硫酸中,黑色物质是什么?值得探究!
学生2:,我也观察到黑色颗粒状物质,后来逐渐转变为灰白色固体,我想该灰白色固体极有可能是未溶于浓硫酸的CuSO4。
学生3:你们是否注意到液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色S固体凝聚,会不会液面以上的铜丝与硫发生了反应,我查资料发现:2Cu+S = Cu2S(黑色)。
材料二:探究实验剪辑
实验1 将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝绿色;将光亮的铜丝置入加热的硫蒸气中变黑,然后插入稀硫酸中无变化。
实验2 截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸,黑色明显变浅,溶液呈蓝绿色。
实验3 将溶液中的黑色颗粒状物质,经过滤、稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减少10%左右。
根据上述材料回答下列问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为______________。
(2)A试管上方的长导管的作用是_________________;D、E两支试管中CCl4的作用是_____________。
(3)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:_______________。
(4)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:______________。设计实验验证你的猜想_____________。
(5)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是_______。(写化学式)
查看答案和解析>>
科目: 来源: 题型:
【题目】铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)元素金(Au)处于周期表中的第6周期,与Cu同族,金原子最外层电子排布式为_________;一种铜合金晶体具有立方最密堆积的结构,在晶胞中铜原子处于面心,金原子处于顶点位置,则该合金中铜原子与金原子数量之比为_____,该晶体中,原子之间的作用力是________;
(2)上述晶体具有储氢功能,氢原子可进入到由铜原子与金原子构成的四面体空隙中。若将铜原子与金原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式应为_____________。
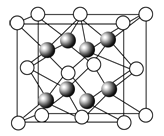
(3)CuSO4晶体的构成微粒是____和____,微粒间的作用力是_______,该晶体属于____晶体;
(4)SO42-中S以sp3杂化,SO42-的立体构型是__________________________;
(5)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年12月以来,我国武汉等地相继暴发了新冠肺炎,为此我国政府和相关部门采取了多项措施控制疫情。75%乙醇和84消毒液等均能有效灭活新冠病毒。84消毒液的主要成分是次氯酸钠。设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.74.5g次氯酸钠中含有的离子数目为2NA
B.1mol次氯酸钠与足量盐酸反应转移的电子数为2NA
C.46g75%乙醇中含有的氧原子数大于6NA
D.利用氯气和氢氧化钠溶液反应制取0.1mol次氯酸钠需要消耗2.24L氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com