
科目: 来源: 题型:
【题目】将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到a L混合气体。将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为
A. 2:1:1
B. 1:1:2
C. 1:2:1
D. 4:3:1
查看答案和解析>>
科目: 来源: 题型:
【题目】Cu3N具有良好的电学和光学性能,在电子工业领城、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的作用。
(1)Cu+的核外电子排布式为__________;N元素与O元素的第一电离能比较:N____O(填“>”、“<”或“=”)。
(2)与N3-含有相同电子数的四原子分子的空间构型为____________________。
(3)在Cu催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中醛其(![]() )碳原子的杂化方式为_________。
)碳原子的杂化方式为_________。
(4)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被C1-取代可生成Cu(H2O)2Cl2,试画出其具有极性的分子的结构式________________。
(5)Cu3N的晶胞结构如图所示,N3-的配位数为________;若晶胞棱长为anm,NA表示阿伏加德罗常数的值,则Cu3N的密度p=______g/cm3 [用含a 和NA 的式子表示,Mr(Cu3N)=206]

查看答案和解析>>
科目: 来源: 题型:
【题目】两种金属的混合物3g投入盐酸中,收集到1.12L氢气(标准状况),不可能构成此种混合物的是( )
A.Mg和AlB.K和CaC.Na和CuD.K和Na
查看答案和解析>>
科目: 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。

下列说法不正确的是
A. 异戊二烯所有碳原子可能共平面
B. 可用溴水鉴别M和对二甲苯
C. 对二甲苯的一氯代物有2种
D. M的某种同分异构体含有苯环且能与钠反应放出氢气
查看答案和解析>>
科目: 来源: 题型:
【题目】下列描述中正确的是
A.BeCl2为V形的极性分子
B.ClO4的空间构型为正四面体形
C.P4和CH4都是正四面体分子且键角都为109°28′
D.H2O和CO32的中心原子均为sp3杂化
查看答案和解析>>
科目: 来源: 题型:
【题目】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)铬是一种硬而脆、抗腐蚀性强的金属,常用于电镀和制造特种钢。基态Cr原子中,电子占据最高能层的符号为______,该能层上具有的原子轨道数为________,电子数为________。
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能是否符合这一规律?________(填“是”或“否”),原因是_____________________________________________ (如果前一问填“是”,此问可以不答)。
(3)镓与第ⅤA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如下图所示(白色球代表As原子)。在GaAs晶体中,每个Ga原子与________个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为________。
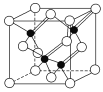
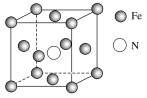
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为________;设晶胞边长为a cm,阿伏加德罗常数为NA,该晶体的密度为________ g·cm-3(用含a和NA的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知阿伏加德罗常数的值为NA,根据所学知识填空。
(1)3molH2O含有__个H2O;
(2)含0.4molAl3+的Al2(SO4)3中所含的SO42-的质量是__g;
(3)已知NH3的相对分子质量为17,则NH3的摩尔质量为__g/mol;
(4)若某原子的摩尔质量为Mg·mol-1,则一个该原子的真实质量是___g;
(5)CO2中含有6.02×1023个O,则CO2的物质的量为__mol;
(6)6.02×1022个OH-的电子物质的量为___mol。
(7)已知一个铁原子的质量为bg,则铁的摩尔质量为___g/mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:![]()
![]()
![]() (R、R'可表示烃基或官能团)。A可发生如图转化(方框内物质均为有机物,部分无机产物已略去):
(R、R'可表示烃基或官能团)。A可发生如图转化(方框内物质均为有机物,部分无机产物已略去):
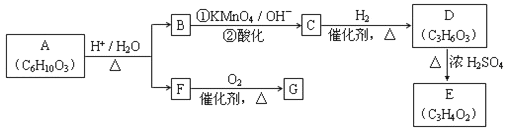
请回答:
(1)F的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1mol F与足量金属钠作用产生H2 22.4L(标准状况),则F的分子式是_____,名称是__________.
(2)G与F的相对分子质量之差为4,则G具有的性质是______(填字母)
a.可与银氨溶液反应 b.可与乙酸发生酯化反应
c.可与氢气发生加成反应 d.1mol G最多可与2mol新制Cu(OH)2发生反应
(3)D能与NaHCO3溶液发生反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是______________,该反应类型是_____反应
(4)H与B互为同分异构体,且所含官能团与B相同,则H的结构简式可能是:_________.
(5)A转化为B和F的化学方程式是__________.
(6)A的同分异构体含有两种官能团,该化合物能发生水解,且1mol该化合物能与4mol银氨溶液反应,符合该条件的同分异构体一共有__________种。
查看答案和解析>>
科目: 来源: 题型:
【题目】乳酸亚铁晶体([CH3CH(OH)COO]2Fe·3H2O,Mr=288) 可由乳酸与FeCO3反应制得,它易溶于水,是一种很好的补铁剂。
Ⅰ.制备碳酸亚铁(装置如图所示)
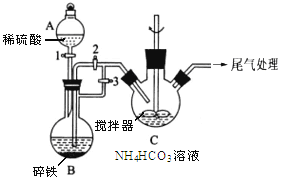
(1)仪器A的名称是______________ ;
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是___________________________________________________________;然后关闭活塞1,接下来的操作是_______________; 装置C中发生反应的离子方程式为______________ 。
Ⅱ.制备乳酸亚铁
向纯净的FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)为防止乳酸亚铁变质,在上述体系中还应加入____________________________________________________________________________
(4)为证明乳酸亚铁中含有Fe2+,选择的检验试剂为_______________________________________________________________________;
Ⅲ. 乳酸亚铁晶体纯度的测量
经过过滤、隔绝空气低温蒸发、冷却结晶、过滤、洗涤、干燥等操作,获得乳酸亚铁晶体后
(5)两位同学分别用不同的方案进行测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度,所得纯度总是大于100%,其原因可能是_________________________________________________________________________________________________________________
②乙同学经查阅文献后改用(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量计算样品纯度(反应中Ce4+被还原为Ce3+),称取6.00g样品配成250.00mL溶液,取25mL,用0.1 molL—1(NH4)4Ce(SO4)4标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各图示与对应的描述相符合的是

A. 图甲表示分别稀释pH=11的NaOH溶液和氨水时溶液pH的变化,图中b>a=100
B. 图乙表示某化学平衡的移动,在t1时改变的条件一定是加入催化剂
C. 图丙表示平衡2NO2(g)![]() N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
D. 图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com