
科目: 来源: 题型:
【题目】在100 mL H2SO4和CuSO4的混合液中,用石墨作电极进行电解,两极上均收集到2.24 L气体(标准状况下),则原混合液中Cu2+的物质的量浓度为( )
A. 1 mol·L-1 B. 2 mol·L-1 C. 3 mol·L-1 D. 4 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】请按要求完成下列各题:
(1)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是__________
(2)某溶液中只含有Na+、Al3+、Cl-、SO42-四种离子,已知前三种离子的个数比为1∶2∶1, 则溶液中Al3+和SO42-的离子个数比为__________。
(3)将一小块钠投入到盛CuSO4溶液的烧杯中,剧烈反应,放出气体并生成蓝色沉淀,其总反应的离子方程式为________________。
(4)将FeSO4溶液与过量NaOH溶液混合并在空气中放置一段时间,整个过程中的现象为______,反应过程分两步,其中第2步反应的化学方程式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2O2和Na2CO3组成的固体混合物与200mL稀盐酸刚好反应完全后,收集到标准状况下的气体3.36L,所得溶液中含NaCl 0.4mol,下列说法错误的是
A.稀盐酸的物质的量浓度是2 mol/L
B.原固体混合物中Na2O2的质量是7.8g
C.上述反应过程中,Na2O2和Na2CO3产生气体的体积比为1:1
D.该混合气体的平均摩尔质量为40 g/ mol
查看答案和解析>>
科目: 来源: 题型:
【题目】表示下列反应的离子方程式正确的是( )
A.铁溶于稀盐酸:2Fe+6H+=2Fe3++3H2↑
B.氯化铝溶液中加过量氨水:Al3++3NH3H2O=Al(OH)3↓+3NH4+
C.碳酸氢铵溶液中加足量氢氧化钠并加热:NH4++OH﹣![]() H2O+NH3↑
H2O+NH3↑
D.氯气通入水中,溶液呈酸性:Cl2+H2O2H++Cl﹣+ClO﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语或名称表述不正确的是( )
A.葡萄糖的分子式:C6H12O6
B.HCl的电子式:![]()
C. 的名称:2﹣甲基丙烷
的名称:2﹣甲基丙烷
D.含有10个中子的氧原子可表示为:![]() O
O
查看答案和解析>>
科目: 来源: 题型:
【题目】A~G七种物质的转化关系如图所示(部分反应物、产物和反应条件未标出)。其中,A、B为中学化学常见的金属单质,C是淡黄色固体,D既能与强酸溶液反应,又能与强碱溶液反应,F溶液中加入AgNO3溶液产生不溶于稀硝酸的白色沉淀,E和G焰色反应均呈黄色。①、④均为燃烧反应。
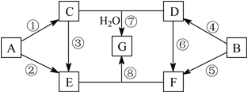
请回答下列问题:
(1)D的化学式____________,G的化学式____________。
(2)按要求写出下列反应的方程式:
③的化学方程式:___________________,
B与E的溶液反应的离子方程式:________________。
(3)将E的溶液逐滴加入到F的溶液中至过量,其现象是_____,总反应的离子方程式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铜矿主要成分是二硫化亚铁铜(CuFeS2)。黄铜矿经熔炼、煅烧后得到粗铜和炉渣,冶炼过程的主要反应有:

(1)二硫化亚铁铜也可以表示为CuS·FeS,其中硫元素的化合价是____。
(2)反应②中还原剂是________。
(3)某校学习小组用炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制备铁红,进行如下实验。
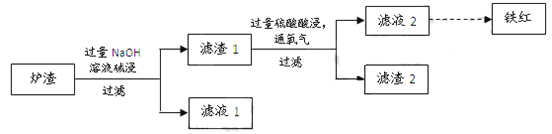
① 炉渣碱浸时反应的离子方程式是_____、_____。
② 滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是________;为检验铁元素是否被氧化完全,应进行的实验是:取少量滤液2于试管中_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室进行二氧化硫制备与性质实验的组合装置如图所示,部分夹持装置未画出。

请回答下列问题:
(1)在组装好装置后,首先要进行的实验操作为_________________________________。
(2)为检验SO2与Na2O2的反应是否有氧气生成,装置B中盛放的试剂X应为________,装置D中碱石灰的作用是_______________________________________________。
(3)关闭弹簧夹2,打开弹簧夹1,注入70%的硫酸至浸没三颈烧瓶中的固体,检验SO2与Na2O2反应是否有氧气生成的操作及现象是_____________________________________。
(4)关闭弹簧夹1,打开弹簧夹2,残余气体进入装置E、F、G中,能说明I-的还原性弱于SO2的现象为_________________。发生反应的离子方程式是______________________。
(5)为了验证装置E中SO2与FeCl3发生了氧化还原反应,某学生设计了如下实验:取少量装置E中的溶液于试管中,向其中加入稀硝酸酸化的BaCl2溶液,产生白色沉淀,并由此判断SO2与FeCl3发生了氧化还原反应。上述方案是否合理?________(填“合理”或“不合理”),原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ/mol,下列说法正确的是( )
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.该反应中的能量变化可用如图来表示
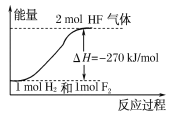
查看答案和解析>>
科目: 来源: 题型:
【题目】在体积为VL的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)![]() 2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法不正确的是( )
2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法不正确的是( )

A.由图可知:T1>T2
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com