
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值。下列的说法中,正确的是( )
A. 4.6g金属钠由原子完全变为Na+ 离子时,失去的电子数为0.1NA
B. NA 个氧气分子与NA 个氢气分子的质量比为8︰1
C. 0.2 NA个硫酸分子与19.6g磷酸(相对分子质量:98)含有相同的氧原子数
D. 22.4L的氮气所含有的原子数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,可逆反应A(g)+2B(g)![]() 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A.C的生成速率与C分解的速率相等
B.单位时间内生成nmol A,同时生成2nmol B
C.单位时间内消耗nmol A,同时生成2nmol C
D.B的生成速率与C分解的速率相等
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2。“气化炉”中主要反应有:
C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJmol﹣1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=﹣41.2kJmol﹣1
(1)气化炉中CO2与C反应转化为CO,该反应的热化学方程式是___。
(2)用煤炭气合成甲醇的反应为CO(g)+2H2(g)CH3OH(g)。在密闭容器中,将CO和H2按物质的量1:2混合反应,CO的平衡转化率与温度、压强的关系如图所示。
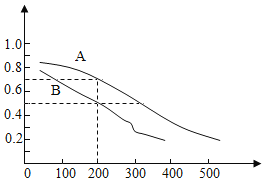
①生成甲醇的反应为___反应(填“放热”或“吸热”)。
②图中两条曲线分别表示压强为0.1MPa和5.0MPa下CO转化率随温度的变化,其中代表压强是5.0MPa的曲线是___(填“A”或“B”)。
③在不改变反应物用量的前提下,为提高CO转化率可采取的措施有___(答出一种即可)。
④压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法错误的是( )

A.通入CH4的一端为原电池的负极,通入空气的一端为原电池的正极
B.0<V≤22.4 L时,电池总反应的化学方程式为CH4+2O2+2KOH=K2CO3+3H2O
C.22.4 L<V≤44.8 L时,负极电极反应为CH4-8e-+![]() +3H2O=
+3H2O=![]()
D.V=33.6 L时,溶液中只存在阴离子![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】把5.1 g铝镁合金的粉末放入100 mL某盐酸中,恰好完全反应,标准状况下收集到5.6 L H2。试计算(注意:无计算过程不给分):
(1)该盐酸的物质的量浓度是多少?_____________
(2)该合金中铝的质量为多少克?_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
化学方程式 | K(t1) | K(t2) |
F2+H2 | 1.8×1036 | 1.9×1032 |
Cl2+H2 | 9.7×1012 | 4.2×1011 |
Br2+H2 | 5.6×107 | 9.3×106 |
I2+H2 | 43 | 34 |
(1)已知t2>t1,HX的生成反应是___反应(填“吸热”或“放热”)。
(2)HX的电子式是___。
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是___。
(4)X2都能与H2反应生成HX,用原子结构解释原因:___。
(5)K的变化体现出X2化学性质的递变性,用原子结构解释原因:___,原子半径逐渐增大,得电子能力逐渐减弱。
(6)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,___(选填字母)。
a.在相同条件下,平衡时X2的转化率逐渐降低
b.X2与H2反应的剧烈程度逐渐减弱
c.HX的还原性逐渐减弱
d.HX的稳定性逐渐减弱
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:

请回答下列问题:
(1)实验室只有100mL、250mL、500mL三种规格的容量瓶,但要配制480 mL 0.50 mol/L的稀硫酸,需量取该浓硫酸______mL。
(2)接下来完成此实验你将用到的仪器有20mL量筒、烧杯、玻璃棒、胶头滴管、____________。
(3)使用容量瓶前必须进行的一步操作是____________。
(4)要从所配溶液中取出10 mL稀释至20 mL,则稀释后溶液的物质的量浓度为__________。
(5)下列操作会使所配溶液浓度偏低的是__________。
A. 用量筒量取浓硫酸,读数时仰视刻度线
B. 转移溶液时未洗涤烧杯
C. 定容时俯视容量瓶的刻度线
D. 定容摇匀后,发现液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】通过卤素间的反应实验,可以比较出卤素单质氧化性的强弱。实验如下:

下列说法不正确的是
A. CCl4起到萃取、富集I2的作用
B. a中下层变无色,说明I2 转化为I-
C. Ⅲ中发生反应的离子方程式为:Br2 + 2I-=== I2 + 2Br-
D. 依据a、b中现象,可以证明Cl2的氧化性比 Br2强
查看答案和解析>>
科目: 来源: 题型:
【题目】镁与稀硝酸的反应为:Mg+ HNO3(稀)—— Mg(NO3)2+ NO↑+ H2O
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目。________
(2)该反应中,还原产物是_________,HNO3表现了______________(选填“还原性”、“氧化性”、“酸性”、“碱性”)。
(3)若反应过程中转移的电子为0.6 mol,则被还原的硝酸物质的量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com