
科目: 来源: 题型:
【题目】(1)某元素原子M层电子数是K层电子数的一半,该元素的原子结构示意图是______________。
(2)碘的质子数为53,碘有多种核素,其中中子数为74的核素的原子符号是________。
(3)某阳离子ARn+,核外共有x个电子,则该原子核内的中子数为 __________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学反应属于右图阴影部分的是( )
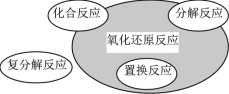
A.CO2+2Mg![]() 2MgO+C
2MgO+C
B.2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
C.2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
查看答案和解析>>
科目: 来源: 题型:
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如下。
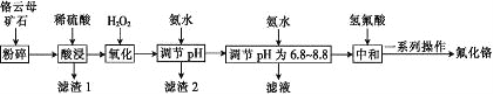
下表列出了相关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 | Fe(OH)2 |
开始沉淀的pH | 2.3 | 8.8 | 4.9 | 7.5 |
沉淀完全的pH | 4.1 | 10.4 | 6.8 | 9.7 |
请回答下列问题:
(1)将铬云母矿石粉碎的目的是___________。
(2)Cr2O3与稀硫酸反应的化学方程式为________________。
(3)第一次滴加氨水调节pH范围为______。
(4)第二次滴加氨水调节pH 为6.8~8.8的目的是___________,Cr(OH)3与 Al(OH)3 一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烷(C3H8)熔融盐燃料电池和锌蓄电池均为用途广泛的直流电源,放电时二者的总反应分别为C3H8+5O2=3CO2+4H2O,2Zn+O2=2ZnO。用丙烷(C3H8)燃料电池为锌蓄电池充电的装置如图所示,下列说法不正确的是

A. 物质M为CO2
B. 燃料电池消耗1mo1 O2时,理论上有4 mol OH-透过b膜向P电极移动
C. a膜、b膜均适宜选择阴离子交换膜
D. 该装置中,锌蓄电池的负极反应式为Zn+2OH--2e-=ZnO+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。
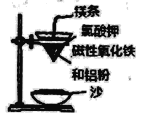
(l)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图)进行铝热反应,现象很壮观。使用镁条和氯酸钾的目的是___________。
(2)某同学取反应后的“铁块”和稀硝酸反应制备Fe(NO3)3溶液,其离子方程式为__________,溶液中可能含有Fe2+,其原因是___________;
(3)可通过KClO溶液与Fe(NO3)3溶液的反应制备高铁酸钾(K2FeO4),如图所示是实验室模拟工业制备KClO溶液装置。已知氯气和热碱溶液反应生成氯化钾和氯酸钾和水

①盛装饱和食盐水的B装置作用为______________;
②反应时需将C装置置于冷水浴中,其原因为___________;
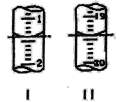
(4)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0 mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如图所示:
①终点II的读数为_______mL。
②原样品中高铁酸钾的质量分数为_________。[M(K2FeO4)=198g/mol]
③若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数_______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用0.0500 mol·L-1H2C2O4溶液滴定 25.00 mL0.l000mol·L-1NaOH溶液所得滴定曲线如图。下列说法正确的是()
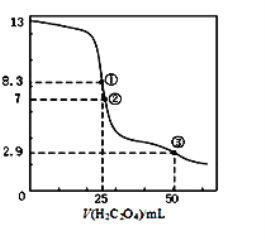
A.点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-)
B.点②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C.点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D.滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知2Mg+CO2![]() 2MgO+C,某同学推测钠与CO2也能反应,为探究反应产物,利用下图装置进行实验。(已知PdCl2能被CO还原为黑色的Pd,饱和NaHCO3溶液可以用于除去CO2 中的HC1气体)
2MgO+C,某同学推测钠与CO2也能反应,为探究反应产物,利用下图装置进行实验。(已知PdCl2能被CO还原为黑色的Pd,饱和NaHCO3溶液可以用于除去CO2 中的HC1气体)
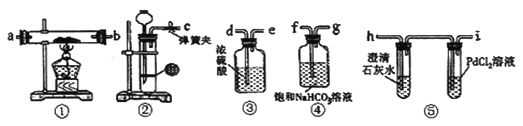
(1)装置②中用稀盐酸与CaCO3反应制备CO2,制备该气体时发生反应的离子方程式是_______。
(2)请将图中各装置按顺序连接(填裝置接口字母): c接___,__接___,___接____,__接____。
(3)装置③的作用是_______。
(4)检查完装置气密性并装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让CO2充满整个装置,当观察到________时再点燃酒精灯。此步操作的目的是_______。
(5)根据下列实验现象,推测并请写出钠与CO2反应的化学方程式。
I.实验过程中若观察到装置⑤PdCl2溶液中有黑色沉淀,且装置①中固体成分(正盐)只有一种,向该固体中加入稀盐酸可产生能使澄清石灰水变浑浊的气体。请写出钠与CO2反应的化学方程式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图。又知AgCl的Ksp=1.8×10-10。下列说法不正确

A.t°C时,Ag2CrO4的Ksp为1×10-8
B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t°C时,Y点和Z点的Ag2CrO4的Ksp相等
D.t°C时,将0.01 mol·L-1AgNO3溶液滴入20 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同回答下列问题:
探究一设计如图所示装置进行“铁与水反应”的实验(夹持仪器略)。
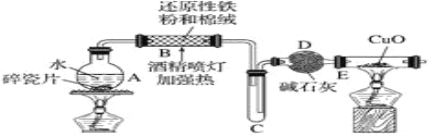
(1)硬质玻璃管B中发生反应的化学方程式为____________。
(2)反应前A中投放碎瓷片的目的是_______。
(3)装置E中的现象是____________。
探究二设计如下实验方案确定反应后硬质玻璃管B中黑色固体的成分。
(4)待硬质玻璃管B冷却后,取少许其中的固体物质溶于___后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分为____ (填序号,下同);若溶液未变红色,推断硬质玻璃管B中固体物质的成分为______。
①一定有Fe3O4 ②一定有Fe ③只有Fe3O4 ④只有Fe
(6)另一份用胶头滴管加入_______(填试剂和现象),可以证明溶液中存在Fe2+。
探究三设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。
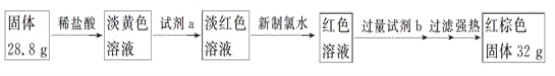
(7)试剂b的化学式是____________。
(8)计算反应后B装置中铁元素的质量分数为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据所学知识完成题目:
(1)用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O_____
(2)钙元素是人体必需的常量元素,所有的细胞都需要钙元素.测定人体血液中钙元素的含量常用到如下两个反应:①CaC2O4+H2SO4=H2C204+CaSO4②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O,上述反应②的还原剂是___;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂___mol,有__mol电子发生转移,相当于测出含钙元素的质量是__g。
(3)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com