
科目: 来源: 题型:
【题目】我国学者研制了一种纳米反应器,用于催化草酸二甲醋(DMO)和氢气反应获得EG。反应过程示意图如下。

下列说法正确的是
A.氢气在该反应中作为催化剂
B.DMO分子中只有碳氧单键发生了断裂
C.MG酸性水解的一种产物在一定条件下能形成高分子化合物
D.EG和甲醇互为同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法不正确的是
A.标况下,3.2g N2H4中含有的N-H键的数目为0.4NA
B.Cu与浓硝酸反应生成4.6 g NO2和N2O4混合气体时,转移的电子数为0.1NA
C.2 mol的CO2和H2O(g)的混合气体与过量Na2O2充分反应生成气体的分子数为NA
D.将1 mol Cl2通入足量水中,HClO、Cl-、ClO-的粒子数之和为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表是元素周期表的一部分。
H | He | ||||||
Li | Be | B | C | N | O | F | Ne |
Na | Mg | Al | Si | P | S | Cl | Ar |
请回答下列问题。
(1)非金属性最强的元素名称为___________,它位于元素周期表中的位置___________。
(2)硅元素的原子结构示意图是____________,其最高价氧化物是____________(填“酸性”或“碱性”)氧化物。
(3)硼酸(H3BO3)的酸性_________(填“>” 或“<”)碳酸(H2CO3)的酸性,说明你判断的理由:__________________________。
(4)NH3的电子式为________________,它属于____________(填“离子”或“共价”)化合物。NH3的还原性_________(填“>” 或“<”)PH3的还原性。
(5)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,利用培养皿进行实验。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。
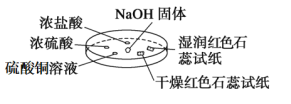
下表中对实验现象所做的解释不正确的是( )
选项 | A | B | C | D |
实验 现象 | 浓盐酸附近产生白烟 | 浓硫酸附近无明显现象 | 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 | 硫酸铜溶液变浑浊 |
解释 | NH3与HCl反应产生了NH4Cl固体 | NH3与浓硫酸不发生反应 | NH3与水反应生成了NH3·H2O,电离出OH-使红色石蕊试纸变蓝 | 生成Cu(OH)2沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物M是一种新型有机酰胺,在工业生产中有重要的作用,其合成路线如下:
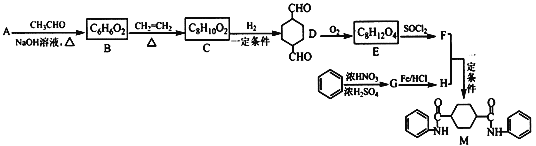
已知:①A是烃的含氧衍生物,相对分子质量为58,碳和氢的质量分数之和为44.8%,核磁共振氢谱显示为一组峰,可发生银镜反应,且5.8 g A完全发生反应生成0.4 mol银。
②R1-CHO+R2-CH2CHO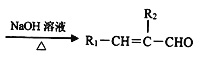
③R-COOH![]() R-COCl
R-COCl
④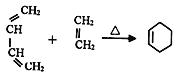
回答下列问题:
(1)A的名称______E的结构简式为____________;G的名称为__________。
(2)B中含有官能团的名称为_______________________。
(3)C→D、D→E的反应类型分别为_____________、_______________。
(4)写出 F+H→M的化学反应方程式_________________。
(5)芳香族化合物W有三个取代基,是C的同分异构体,能与FeCl3溶液发生显色反应。0.5 mol W可与足量的Na反应生成1 g H2,且核磁共振氢谱显示为五组峰,符合以上条件的W的同分异构体共有_______ 种,写出其中一种的结构简式____________。
(6)参照上述合成路线,以C2H4和HOCH2CH2OH为原料(无机试剂任选),设计制备![]() 的合成路线_____________。
的合成路线_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族。五种元素原子半径与原子序数之间的关系如图所示。下列推断正确的是( )

A. 离子半径:Y<Z
B. 氢化物的沸点:Y<T
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、Y、Z、R四种元素组成的常见化合物中含有离子键
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症。制备反应2LaCl3+6NH4HCO3=La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置模拟制备碳酸镧。
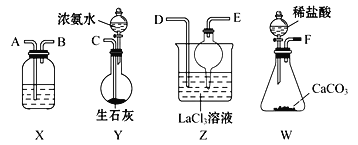
(1)盛放稀盐酸的仪器名称为________________。
(2)制备碳酸镧实验流程中导管从左向右的连接顺序为F→____→____→____→____→______。
(3)W中发生反应的离子方程式为_______Y中发生反应的化学反应方程式为__________
(4)X中盛放的试剂是_________,干燥管的作用为_________________。
(5)Z中通入气体的方式________
A.先通入足量NH3,后通入过量的CO2
B.先通入足量CO2,后通入过量的NH3
C.NH3和CO2同时通入
(6)该化学兴趣小组为探究La2(CO3)3和La(HCO3)3的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为________________,实验过程中,发现乙试管中固体质量与灼烧时间的关系曲线如图所示,则关于两种物质稳定性实验结论为_____。
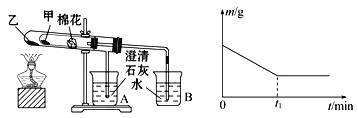
A.稳定性La2(CO3)3>La(HCO3)3
B.稳定性La2(CO3)3<La(HCO3)3
C.无法判断
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是
A. 按上述流程,试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氧化铁
C. 图中所有的转化反应都不是氧化还原反应
D. 反应②的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)黑火药爆炸时发生反应:2KNO3+S+3C=K2S+N2↑+3CO2↑,其中被还原的元素是___,被氧化的元素是___。
(2)在反应MnO2+4HCl(浓)![]() MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是___;被氧化的HCl的物质的量为___。
MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是___;被氧化的HCl的物质的量为___。
(3)在一定条件下,RO3n-和I-发生反应的离子方程式如下:RO3n-+6I-+6H+=R-+3I2+3H2O。该反应中还原剂为___,RO3n-中R元素的化合价是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Ca2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1 mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如右实验:则下列关于原溶液的判断正确的是( )

A.若步骤中Ba(NO3)2和HNO3的混合溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B.无法确定原溶液中是否存在Cl-
C.肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D.肯定不存在的离子是Ca2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com