
科目: 来源: 题型:
【题目】已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
Fe2O3(s)+1/3CO(g)=2/3Fe3O4(s)+1/3CO2(g) ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为( )
A.-218 kJ/molB.-109 kJ/molC.+109 kJ/molD.+218 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】若 m g Na在足量氯气中燃烧,生成固体的质量为(m+3.55)g,则 m g Na与氧气反应,生成的固体的质量为:①2.7g、②3.1g、③3.55g、④3.9g、⑤4.0g( )
A.①②③B.②③④C.③④⑤D.①③⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】密闭容器中有如下反应:L(s)+aG(g) ![]() bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
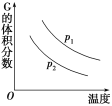
A.正反应为放热反应
B.G的转化率随温度升高而减小
C.化学方程式中的计量数a>b
D.增大压强,容器内气体质量不变
查看答案和解析>>
科目: 来源: 题型:
【题目】2017年我国首艘使用了钛合金材料的国产航母下水。钛(Ti)常温下与酸、碱均不反应,但高温下能被空气氧化。由钛铁矿(主要成分是FeO和TiO2)提取金属钛的主要工艺流程如图,下列说法错误的是

A. 步骤I中碳作还原剂
B. 步骤II中未发生氧化还原反应
C. 步骤III需在氩气环境中进行,防止金属被空气氧化
D. 可用稀硫酸除去金属钛中的少量镁
查看答案和解析>>
科目: 来源: 题型:
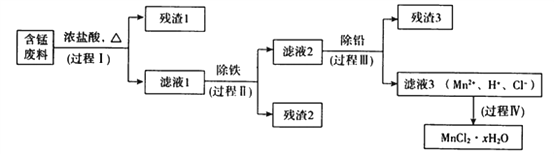
【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程如下:
资料a.Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b.生成氢氧化物沉淀的pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
注:金属离子的起始浓度为0.1 mol·L-1
(1)过程Ⅰ的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnOOH与浓盐酸反应的离子方程式是_______________________________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:_________________________________________。
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3+2Cl-
b.4Fe2++O2+4H+=2Fe3++2H2O
c.……
写出c的离子方程式:____________________。
(2)过程Ⅱ的目的是除铁。有如下两种方法,
ⅰ.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ⅱ.焙烧法:将滤液1浓缩得到的固体于290℃焙烧,冷却,取焙烧物,加水溶解,过滤,再加盐酸酸化至pH小于5.5。
已知:焙烧中发生的主要反应为2FeCl3+3O2=2Fe2O3+3Cl2,MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在_____________之间。
②两种方法比较,氨水法除铁的缺点是____________。
(3)过程Ⅲ的目的是除铅。加入的试剂是____________。
(4)过程Ⅳ所得固体中的x的测定如下,取m1g样品,置于氯化氢氛围中加热至失去全部结晶水时,质量变为m2g。则x=____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用铁的氧化物在高温条件下循环裂解水制氢气的流程如下图所示。

(1)反应I的化学方程式为:Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
(2)反应III为:CO2(g)+C(s)![]() 2CO(g)
2CO(g) ![]() H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
(3)上述流程中铁的氧化物可用来制备含有Fe3+的刻蚀液,用刻蚀液刻蚀铜板时,可观察到溶液颜色逐渐变蓝,该反应的离子方程式为_________。刻蚀液使用一段时间后会失效,先加酸,再加入过氧化氢溶液,可实现刻蚀液中Fe3+的再生,该反应的离子方程式为_________。
(4)上述流程中碳的氧化物可用来制备碳酰肼[CO(NHNH2)2,其中碳元素为+4价]。加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳。该反应的化学方程式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于数以千万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可代替的。
Ⅰ.现有以下物质:①H2O ②Cu ③BaCO3 ④Fe(OH)3胶体 ⑤酒精 ⑥CO2 ⑦稀硫酸
(1)以上物质中属于混合物的是________(填序号,下同),属于电解质的是________。
(2)向④中逐滴滴加⑦,可观察到的现象是_____________________。
Ⅱ.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(3)下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是________(填字母)。
![]()
(4)有同学认为所有酸碱中和反应均可表示为H++OH-=H2O。请举个例子反驳上述观点(用离子方程式表示)_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
化学键 | H—H | Cl—Cl | H—Cl |
生成1 mol化学键时放出的能量 | 436 kJ/mol | 243 kJ/mol | 431 kJ/mol |
则下列热化学方程式不正确的是 ( )
A.1/2H2(g)+1/2Cl2(g)===HCl(g)ΔH=-91.5 kJ/mol
B.H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ/mol
C.2HCl(g)===H2(g)+Cl2(g) ΔH=+183 kJ/mol
D.1/2H2(g)+1/2Cl2(g)===HCl(g)ΔH=+91.5 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】向两份等体积、等浓度,pH不同的FeSO4,溶液中逐滴加入NaClO溶液,实验测得溶液pH随加入NaClO溶液体积变化曲线如下图,实验现象如下表。下列说法不正确的是()
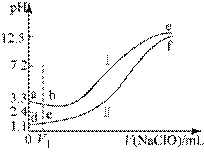
实验 | 实验现象 |
Ⅰ | 滴入V1mL NaClO溶液产生大量红褪色沉淀 |
Ⅱ | 滴入V1mL NaClO溶液,溶液变黄,未见沉淀,继续滴加出现红褪色沉淀 |
A.a~b段主要反应的离子方程式为:![]()
B.d~e段主要反应的离子方程式为:![]()
C.c、f点pH接近的主要原因是:![]()
D.向c点溶液中加入过量的浓盐酸,沉淀溶解并有刺激性气味的气体放出
查看答案和解析>>
科目: 来源: 题型:
【题目】我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图所示),促进了世界制碱技术的发展.下列有关说法正确的是( )
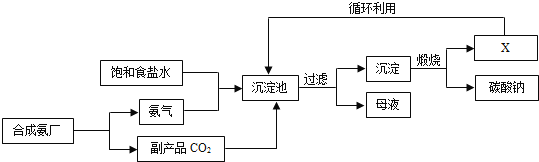
A.沉淀池中的反应物共含有五种元素
B.过滤得到的“母液”中一定只含有两种溶质
C.图中X可能是氨气
D.通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com