
科目: 来源: 题型:
【题目】某同学设计如图装置,研究非金属元素性质变化规律。
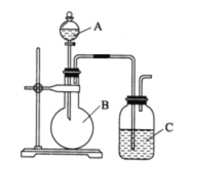
已知:高锰酸钾在常温下与浓盐酸反应产生氯气,离子方程式为______。
(1)如果C中装饱和的H2S溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,证明氯的非金属性比硫的非金属性________(填“强”或“弱”或“无法判断”;请用电子式表示H2S的形成过程:_____。
(2)利用如图装置证明Cl2氧化性强于I2的氧化性。则A中装浓盐酸,B中装入高锰酸钾粉末, C中装入淀粉KI溶液,则C中现象是______。
(3)现有浓硝酸、大理石、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:非金属性:N > C > Si。C中装试剂______,实验现象为_________该装置存在不足之处,改进措施为:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中,对可逆反应A+3B![]() 2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断错误的是
2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断错误的是
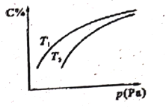
A.若正反应方向Q<0,则T1>T2
B.A可能为气体
C.压强增大时,混合气体的平均相对分子质量增大
D.B不一定为气体
查看答案和解析>>
科目: 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l),现用如图1装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g。请回答下列问题:
2PbSO4(s)+2H2O(l),现用如图1装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g。请回答下列问题:
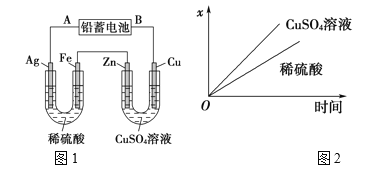
(1)A是铅蓄电池的________极,铅蓄电池正极反应式为:______。
(2)Ag电极的电极反应式是______,该电极的电极产物共________g。
(3)Cu电极的电极反应式是________,CuSO4溶液的浓度_______(填“减小”“增大”或“不变”)。
(4)如图2表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示_______。
a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原是一类重要的反应。
(1)某同学写出以下三个化学方程式(未配平)
①N2O4+H2O→HNO3+HNO2 ②NO+HNO3→N2O3+H2O ③NH3+NO→HNO2+H2O
其中你认为一定不可能实现的是(填代号)____________;
(2)以下反应中H2O2仅体现还原性的是(填代号)____________,H2O2既体现氧化性又体现还原性的是(填代号)____________,从反应中判断H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是_______________;
A.H2O2+2Fe2++2H+=2Fe3++2H2O
B.2H2O2=2H2O+O2↑
C.Ag2O+H2O2=2Ag+O2↑+H2O
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
E.H2O2+MnSO4=MnO2+H2SO4
(3)用“双线桥法”标明以下反应中电子转移的方向和数目________,若反应中有3.01×1023个电子转移,则被氧化的还原剂的物质的量为___________。
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知:① CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
② CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
由上述方程式可知:CH3OH的燃烧热________(填“大于”“等于”或“小于”)192.9 kJ/mol。
已知水的气化热为44 kJ/mol。则表示氢气燃烧热的热化学方程式为__________。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。
已知:① 2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)===H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式是______。
(3)已知:① Fe(s)+1/2O2(g)===FeO(s) ΔH1=-272.0 kJ/mol
② 2Al(s)+3/2O2(g)===Al2O3(s) ΔH2=-1675.7 kJ/mol
Al和FeO发生铝热反应的热化学方程式是______。某同学认为,铝热反应可用于工业炼铁,你的判断是______(填“能”或“不能”),你的理由是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】现定义pOH=![]() lg[OH],如图说法正确的是
lg[OH],如图说法正确的是
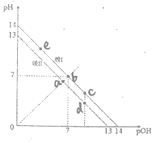
A.图中线II的温度低于室温
B.图中五点Kw间的关系是:e>b>c>a>d
C.c、d、e处的水溶液中的水的电离平衡一定被抑制
D.a点时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液显碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C3(g) △H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
2C3(g) △H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为____________。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将______(填“增大“、“减小”或“不变”)
(3)恒压的密闭容器中发生可逆反应2A2(g)+B2(g)![]() 2C3(g) △H=-Q1 kJ/mol(Q1>0),在一定条件下达到化学平衡状态的标志是 (____)
2C3(g) △H=-Q1 kJ/mol(Q1>0),在一定条件下达到化学平衡状态的标志是 (____)
A. v(A2):v(C3)=3:2
B.反应混合气体的密度不再变化
C.反应混合气体的平均摩尔质量不再变化
D.A2、B2两种反应物的转化率不再变化
E. A2、B2、C3三种物质的浓度相等
F.密闭容器内的压强不再变化
(4)改变某一条件,得到如上图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是____;
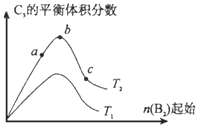
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容器,起始时加入2 molA2和1 molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2_______Q4(填“>”、“<”或“=”)。
(6)下列措施可以同时提高反应速率和B2的转化率是_______(填选项序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的C3 d.升高温度
查看答案和解析>>
科目: 来源: 题型:
【题目】已知图一表示的是可逆反应 CO(g)+H2(g)![]() C(s)+H2O(g)-Q(Q>0)的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g)-Q(Q>0)的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)![]() N2O4(g)+Q(Q>0)的浓度(c)随时间 t 的变化情况,下列 说法中正确的是
N2O4(g)+Q(Q>0)的浓度(c)随时间 t 的变化情况,下列 说法中正确的是
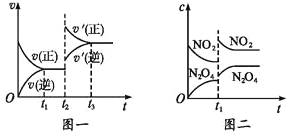
A.图一 t2 时刻改变的条件可能是升高了温度或增大了压强
B.图一 t2 时刻改变的条件可能是通入了 CO 气体
C.图二 t1 时刻改变的条件可能是升高了温度或增大了压强
D.图二 t1 时刻改变的条件是增大压强,则混合气体的平均相对分子质量将减小
查看答案和解析>>
科目: 来源: 题型:
【题目】在KNO3固体样品中含有少量的KCl、BaCl2杂质,为了提纯KNO3并分离得到BaCl2,进行如下实验操作:

(1)加入过量K2CO3所发生反应的离子方程式为_________________________________;
(2)结合下图各物质的溶解度曲线可知操作③的名称是_________________;

(3)有人认为操作③之前无需加入过量的酸b,也能得到纯净的固体1,你认为该观点是否正确?并做出解释______________________________________。
(4)用制得的 KNO3固体配制 200 mL0.2mol/L KNO3 溶液。
①本实验用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、量筒、还有_______________;
②下列情况会使所配制的KNO3 溶液的浓度偏高的是______________(填字母)。
A.没有洗涤烧杯和玻璃棒 B.容量瓶不干燥,含有少量蒸馏水
C.定容时仰视刻度线 D.定容时俯视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】FeCl3是中学实验室常用的试剂,可以用来制备氢氧化铁胶体。
(1)下列制备氢氧化铁胶体的操作方法正确的是____________(填字母);
A.向饱和氯化铁溶液中滴加少量的氢氧化钠稀溶液
B.加热煮沸氯化铁饱和溶液
C.在氨水中滴加氯化铁浓溶液
D.在沸水中滴加饱和氯化铁溶液,煮沸至液体呈红褐色
(2)写出制备氢氧化铁胶体的离子方程式_______________;
(3)下列与胶体性质无关的是_____________(填字母);
A.河流入海口处形成沙洲
B.使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血
C.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
D.在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀
E.冶金厂常用高压电除去烟尘
(4)从溶液中分离提纯Fe(OH)3胶体的方法叫_____________;
(5)向氢氧化铁胶体中逐滴加入稀硫酸至过量的现象是_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com