
科目: 来源: 题型:
【题目】下列变化是氧化还原反应的是
A.CaO+CO2=CaCO3B.SiO2+2NaOH=Na2SiO3+H2O
C.NH4HCO3![]() NH3↑+H2O+CO2↑D.2FeSO4
NH3↑+H2O+CO2↑D.2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O(摩尔质量376g/mol)是一种氧气吸收剂,红棕色晶体,易被氧化;易溶于盐酸,微溶于乙醇,难溶于水和乙醚。其制备装置(已省略加热及支持装置)和步骤如下:
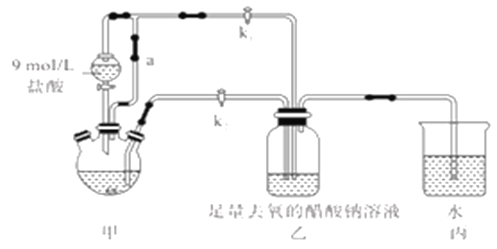
①检查装置气密性,往三颈烧瓶中依次加入过量锌粉,200mL0.200mol/LCrC13溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶內的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中。当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到11.28g[Cr(CH3COO)2]2·2H2O
(1)装置甲中连通管a的作用是________,如何检验甲装置的气密性是否良好?__________。
(2)生成红棕色晶体的离子反应方程式____________________________。
(3)步骤③中溶液自动转移至装置乙中的实验操作为________________。
(4)装置丙的作用是________________。
(5)为得到纯净干燥的产品,洗涤时按使用的先后顺序选用下列洗涤剂__________(填序号)。
①乙醚 ②蒸馏水(煮沸冷却) ③无水乙醇 ④盐酸
(6)本实验中[Cr(CH3COO)2]2·2H2O的产率是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2。请 回答下列问题:
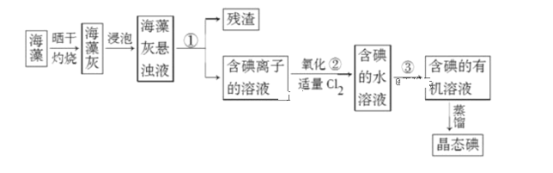
(1)指出提取碘的过程中有关实验操作①和③的名称:________;________。
(2)在 3 mL 碘水中,加入 1 mL 四氯化碳,振荡、静置后,观察到试管里的分层现象是下图中的________ (注:试管中深色区为紫红色溶液)。

(3)最后一步蒸馏制得晶态碘时,发现冷凝到锥形瓶中的有机物呈淡紫色,推测其原因是__________
Ⅱ.欲配制 480mL0.5mol·L-1 的 NaOH 溶液,试回答下列问题。
(4)配制上述溶液需要的仪器有:药匙、托盘天平、量筒、玻璃棒、________。
(5)某学生实际配制的 NaOH 溶液的浓度为 0.51mol·L-1,原因可能是_________。
A 使用滤纸称量 NaOH 固体 B 容量瓶中原来存有少量水
C 溶解后的烧杯未经多次洗涤 D 用胶头滴管加水定容时俯视刻度
E 加水时超过刻度线,用胶头滴管吸出 F 转移溶液之前未经冷却
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。 合成塔中发生反应为: N2(g)+3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。
该温度下此反应的平衡常数K =__________________________。
②保持温度不变,向上述平衡体系中再加入0.1mol CO,当反应重新建立平衡时,水蒸气的总转化率α (H2O)__________。
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1_____573K(填“>”、“<”或“=”)。
T/K | T1 | 573 | T2 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
(3)673K,30MPa下n(NH3) 和n(H2) 随时间变化的关系如下图所示依据上图,下列有关叙述正确的是(填写序号)_________________。

A.c点表示n(NH3)和n (H2)相等
B.c点表示NH3生成速率与NH3分解速率相同
C.e点和d点时反应的平衡常数相同
D.c点时正反应速率大于逆反应速率
(4)用NO2溶于水制硝酸:3NO2+H2O![]() 2HNO3+NO。从生产流程看,吸收塔中需
2HNO3+NO。从生产流程看,吸收塔中需
要补充空气,其原因用化学平衡移动的理论进行解释是______________。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索
利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求回答下列问题:
(1)写出下列物质在水溶液中的电离方程式:
①Ba(OH)2:__________; ②NaHSO4__________
③写出①②水溶液混合后恰好沉淀完全的离子方程式______________
(2)相同物质的量的O2和O3的质量比__________,分子个数比为 __________,所含氧原子的个数比为__________
(3)下列各组物质的分离或提纯,应选用下述方法的哪一种?(填选项字母)
A 分液 B 过滤 C 萃取 D 蒸馏 E 蒸发结晶 F 高温分解
①分离CCl4和H2O__________;
②除去澄清石灰水中悬浮的CaCO3:__________;
③除去CaO固体中少量的CaCO3固体__________;
④从碘水中提取碘__________;
⑤分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物:__________.
查看答案和解析>>
科目: 来源: 题型:
【题目】已知十种物质:①H2O ②空气 ③ Mg ④ CaO ⑤H2SO4 ⑥氢氧化钡⑦饱和FeCl3溶液 ⑧氨水 ⑨HNO3 ⑩胆矾,根据上述提供的物质,回答下列问题:
(1)属于混合物的是__________ (填序号,下同),属于电解质的是__________ 。
(2)上述物质中__________与__________在水溶液中可发生反应,且离子方程式为H++OH-=H2O。
(3)实验室制备少量Fe(OH)3胶体所用的物质有__________,反应的离子方程式为__________;证明有Fe(OH)3胶体生成的实验操作及现象是__________
(4)实验室配制900mL 0.1mol/L硫酸铜溶液,需要称取的溶质(从上述物质中选取)的质量为__________g,从配制好的溶液中取出300mL,其中含有SO42-的数目为__________(设
NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。从工业废水中回收硫酸亚铁和金属铜的工艺流程如图所示。
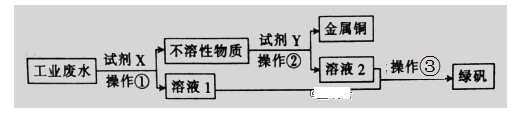
(1)操作③的名称为__________ 。
(2)试剂X为__________(填化学式),操作②涉及的离子反应方程式为__________ 。
Ⅱ.(3)研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5 价砷(As)元素,但它对人体是无毒的,砒霜的成分是 As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素 C=砒霜。该使人中毒过程中维生素 C 是________(填“氧化剂”或“还原剂)
(4)已知某反应中反应物和生成物有:KMnO4、H2SO4、MnSO4、H2C2O4、K2SO4、H2O和一种未知物X。
①若0.5 molH2C2O4在反应中失去1 mol电子生成X,则X的化学式为__________ 。
②将氧化剂和还原剂及配平的系数填入下列方框中,并用单线桥标出电子转移的方向和 数目。__________
![]()
③若已知H2C2O4为弱酸,试写出该反应的离子方程式:__________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验的选项正确的是( )
A. 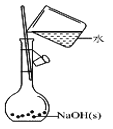 配制0.10mol/LNaOH溶液
配制0.10mol/LNaOH溶液
B. 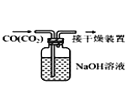 除去CO中的CO2
除去CO中的CO2
C. 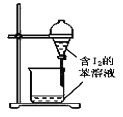 苯萃取碘水中的I2,分出水层后的操作
苯萃取碘水中的I2,分出水层后的操作
D. 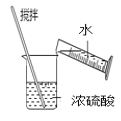 稀释浓硫酸
稀释浓硫酸
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知室温下BaSO4的Ksp =1.1×1010,欲使溶液中c(SO42-)≤1.0×106 mol·L1,应保持溶液中c(Ba2+)≥___________。
(2)向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,反应的离子方程式为_______________
(3)25℃时,有c(CH3COOH)+c(CH3COO-)= 0.1mol·L1的醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。

下列有关溶液中离子浓度关系的叙述正确的是_____________。(错选不得分)
A.pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W 点所表示的溶液中:c(Na+)+c(H+)= c(CH3COOH)+c(OH-)
C.pH = 3.5的溶液中:c(Na+) +c(H+) c(OH-) +c(CH3COOH)= 0.1mol·L1
D.向W点所表示的1.0 L 溶液中通入0.05 mol HCl 气体(溶液体积变化可忽略):c(H+)= c(CH3COOH)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,11.2 LHCl气体中含有的分子数为0.5NA
B.50 mL12 mol/L盐酸与足量Fe反应,转移电子数为0.3NA
C.将0.2 mol FeCl3制成胶体,所得胶体粒子数为0.2NA
D.常温常压下,5.6 g N2和CO混合物中所含有的原子数为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com