
科目: 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
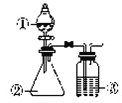
选项 | ① | ② | ③ | 实验结论 |
A | 酸性高锰酸钾 | 浓盐酸 | NaHCO3溶液 | Cl2与水反应生成酸性物质 |
B | 浓硫酸 | 蔗糖 | 澄清石灰水 | 浓硫酸具有脱水性、氧化性 |
C | 浓硝酸 | 铁片 | NaOH溶液 | 铁和浓硝酸反应可生成NO |
D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外小组所做实验的示意图如图所示:图中“→”表示气体流向, M是一种纯净而干燥的气体,Y为另一种气体,E内有红棕色气体产生,实验所用物质只能由下列物质中选取:Na2CO3、Na2O2、NaCl、Na2O、CaCl2、(NH4)2CO3、碱石灰等固体及蒸馏水。据此实验,完成下列填空:

(1)A中所用装置的主要仪器和药品是______________________。
(2)B中所选的干燥剂是________,其作用是______________________________。
(3)C中发生的主要反应的化学方程式:________________________________。
(4)制取Y气体的D装置所用的主要仪器是__________________________。
制取Y气体的化学方程式是________________________。
(5)F中发生反应的化学方程式为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某些化学反应可用下式表示,A+B→C+D+H2O请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式:________
(2)若气体D能使湿润的红色石蕊试纸变蓝,写出该反应的化学方程式: ____________。
(3)若A金属单质,C是一种遇空气会变为红棕色的无色气体,写出该反应的离子方程式______________
(4)若A为难溶于水的固体,C为能使澄清石灰水变浑浊的无色无味气体,请写出符合上式的离子方程式:_____________。
(5)若C、D均为气体且都能使澄清石灰水变浑浊,且D可以使品红褪色,则A与B反应的化学方程式为: _____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2L NO2完全溶于水,转移电子数为0.5NA
B.20g D2O和HTO两种水的组合中含有的中子数为10NA
C.一定温度下,lmol H2和足量碘蒸气反应产生的H-I键数目为2NA
D.标准状况下,22.4L的SO3中含有的O原子数目为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】(化学——物质结构与性质)
离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的 EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:
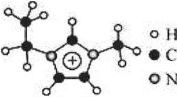
碳原子价层电子的轨道表达式为_____;基态碳原子中,核外电子占据的最高能级的电子云轮廓图为_____形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是_____。NH3比PH3的沸点高,原因是______.
(3)氮元素的第一电离能比同周期相邻元素都大的原因是_____。
(4)己知分子中的大![]() 键可用符号
键可用符号![]() 表示,其中n代表参与形成大
表示,其中n代表参与形成大![]() 键的原子数,m代表参与形成大
键的原子数,m代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() )。EMIM+离子中的五元环跟苯分子相似为平面结构,则EMIM+ 离子中碳原子杂化方式有:_____,其中的大
)。EMIM+离子中的五元环跟苯分子相似为平面结构,则EMIM+ 离子中碳原子杂化方式有:_____,其中的大![]() 键应表示为_____.
键应表示为_____.
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于晶体,其中硼原子的配位数为_____。已知:立方氮化硼密度为dg/cm3, B原子半径为xpm,N原子半径为xpm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为______(列出化简后的计算式)。
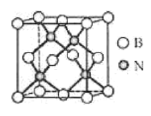
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示甲是某学生验证铜和浓硝酸反应的装置,乙、丙是另外两位同学对甲装置改进后的装置:
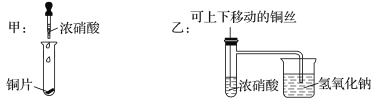
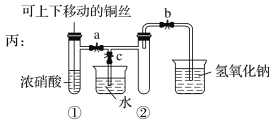
(1)甲、乙、丙三个装置中共同发生的反应的化学方程式是__________________________________。
(2)和甲装置相比,乙装置的优点是①______________________;②________________。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。实验时先关闭活塞________,再打开活塞________,才能使NO2气体充满②试管;当气体充满②试管后,将铜丝提起与溶液脱离。欲使烧杯中的水进入②试管,应该_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和液态H2O。
已知:CH4(g)+2O2(g) = CO2(g)+2H2O(l)= -890.3 kJ/mol
S(s)+O2(g) = SO2(g) AH=-291.2 kJ/mol
则CH4和SO2反应的热化学方程式为________。
(2)在恒容密闭容器中,用H2还原SO2生成S的反应分两步完成(如图1所示),该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
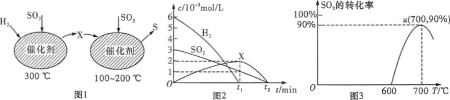
①分析可知X为_____(填化学式),0t1时间段的温度为_____.
②用H2还原SO2生成S的总反应的化学方程式为_____.
(3)焦炭催化还原SO2生成S2,化学方程式为2C(s)+2SO2(g)= S2(g)+2CO2(g)。在恒容密闭容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
①该反应的△H____(填“ > ”或“<”)0。
②计算a点的平衡常数为_____.
(4)工业上用Na2SO3溶液处理硫酸厂的废气SO2得NaHSO3溶液。
①某温度下,用1.0mol/LNa2SO3溶液吸收纯净的SO2,当溶液pH降至5时,吸收能力显著下降,应更换吸收剂。此时溶液中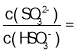 _____。(已知该温度下H2SO3的电离平衡常数:Ka1=1.50
_____。(已知该温度下H2SO3的电离平衡常数:Ka1=1.50![]() 10-2,Ka2=1.25
10-2,Ka2=1.25![]() l0-6)
l0-6)
②用惰性电极电解NaHSO3废水可使吸收液再生,原理如下图所示,M和N为离子交换膜。阳极的电极反应式为:______。
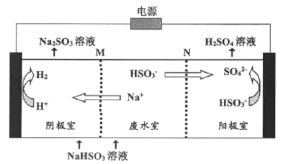
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是( )
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 放电时正极反应为:FeO42-+4H2O+3e-=Fe(OH)3+5OH-
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目: 来源: 题型:
【题目】相对分子质量为M的气态化合物VL (标准状况),溶于mg水中,得到质量分数为w、 物质的量浓度为c mol/L、密度为g/mL的溶液,下列说法正确的是( )
A.相对分子质量 M=22.4mω/(1-ω)V
B.物质的量浓度c=ρv/(MV+22.4m)
C.溶液的质量分数ω=MV/22.4m
D.溶液密度ρ=cω/1000ρω
查看答案和解析>>
科目: 来源: 题型:
【题目】有关煤的综合利用如图所示。下列说法正确的是
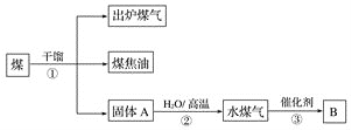
A. ①是将煤在空气中加强热使其分解的过程
B. 煤中含有苯、甲苯、二甲苯等有机物
C. ②是放热的过程
D. B为甲醇或乙酸时,原子利用率均达到100%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com