
科目: 来源: 题型:
【题目】按要求回答问题:
(1)KAl(SO4)2的电离方程式_________。
(2)向石蕊试液中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是_________、_________ (填微粒符号)。
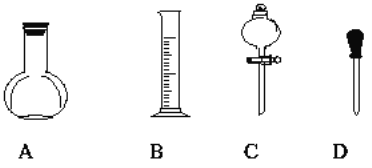
(3)实验室需配制0.5mol/L的硫酸溶液480mL,在下图所示仪器中,配制上述溶液肯定不需要的是___(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是________。
(4)化学方程式H2S+H2SO4(浓)=SO2↑+S↓+2H2O,当生成4.48L(标况)SO2时,转移的电子是__________mol。
(5)下列四个图像中,横坐标表示加入物质的物质的量,纵坐标表示生成沉淀的量或产生气体的量,从A~D中选择符合各题要求的序号填人表中。
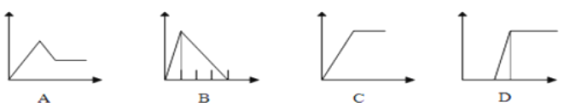
溶液 | 加入的物质 | 序号 |
①AlCl3溶液 | 通入过量的NH3 | ___ |
②Na2CO3和NaOH的溶液 | 滴入过量的盐酸 | ___ |
③NaAlO2溶液 | 滴加稀硫酸至过量 | __ |
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2 mL的稀盐酸。下列对烧杯中的实验现象的描述及原因说明正确的是( )
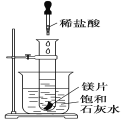
A. 烧杯中出现白色浑浊,原因是试管中的反应放出热量使烧杯中饱和石灰水温度升高,溶质析出
B. 烧杯中出现白色浑浊,原因是试管中的反应吸收热量使烧杯中饱和石灰水温度降低,溶质析出
C. 烧杯中没有任何现象,原因是试管中的反应对烧杯中饱和石灰水不会产生任何影响
D. 烧杯中没有任何现象,原因是试管中的反应既不放出热量,也不吸收热量
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验装置设计与对应结论正确的是( )
选项 | A | B | C | D |
装置 |
|
|
|
|
结论 | 能证明Al(OH)3不溶于氨水 | 能证明非金属性:Cl>C>Si | 验证铁发生析氢腐蚀 | 洗气瓶中产生的白色沉淀是BaSO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】2.8g铁与100 mL稀硫酸恰好完全反应,反应前后溶液体积的变化忽略不计。求:
(1)产生的气体在标准状况下的体积。_______
(2)反应完全后,所得溶液中亚铁离子的物质的量浓度。_______
(3)反应前溶液中H+物质的量溶度。_______
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸,在化学上有这很重要的用途。某实验员想要用草酸晶体(H2C2O42H2O)配制400mL 0.4mol/L的H2C2O4溶液,请回答下列问题
(1)通过计算,该实验员应该用托盘天平称______ g H2C2O42H2O用来做实验。
(2)请写出该实验的实验步骤
a:计算,b称量,c:_____,d:冷却,e:移液f:洗涤g:________,h:摇匀,i:装液。
(3)在次过程中用到的玻璃仪器除了玻璃棒,烧杯,胶头滴管外,还有_____。
(4)上述配制过程中,下列实验操作对所配制的溶液的物质的量浓度有何影响?(选填“偏高”或“偏低”或“无影响”)。
I.称量粉末时物体和砝码位置放反了(___________)
II.移液过程后没有对玻璃棒和烧杯进行洗涤(_________)
III.定容时俯视刻度线(___________)
IV.摇匀时,容量瓶液面低于刻度线,滴加蒸馏水至刻度线(_________)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. AlCl3溶液中加入过量氨水:Al3++4NH3·H2O===AlO![]() +2H2O+4NH
+2H2O+4NH![]()
B. 硫化钠的水解反应:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C. 将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合HCO![]() +Ba2++OH-===BaCO3↓+H2O
+Ba2++OH-===BaCO3↓+H2O
D. 单质铜与稀硝酸反应:Cu+2H++2NO![]() ===Cu2++2NO↑+H2O
===Cu2++2NO↑+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下:
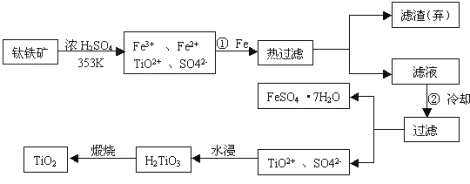
(1)Ti的原子序数为22,位于元素周期表中第_________周期第___________族。
(2)步骤①加铁的目的是___________________;步骤②冷却的目的是__________。
(3)写出流程中生成H2TiO3的离子方程式__________________________________。
(4)上述制备TiO2的过程中,考虑成本和废物综合利用因素,废液中应加入______处理。
(5)由金红石(TiO2 )制取单质Ti,涉及到的步骤为:TiO2→TiCl4![]() Ti
Ti
已知:① C(s) + O2 (g) = CO2 (g) ΔH = -393.5 kJmol-1
② 2CO(g) + O2 (g) = 2CO2(g) ΔH =-566 kJmol-1
③ TiO2 (s) + 2Cl2 (g) = TiCl4 (s) + O2 (g) ΔH = +141kJmol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g) 的ΔH =___________。反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组欲探究浓硝酸的性质。
Ⅰ.木炭与浓硝酸反应:
(1)甲同学设计了图1装置,认为若有红棕色气体产生就说明木炭与浓硝酸发生了反应。写出木炭与浓硝酸反应的化学方程式____________________________。

(2)乙同学认为红棕色气体不能作为木炭与浓硝酸反应的证据,其理由是________。
(3)乙同学设计了图2装置实验,木炭能燃烧,并产生红棕色气体。针对该实验现象,乙同学做出如下假设:
假设a:_____________________________;
假设b:红热木炭使HNO3分解产生NO2,NO2可能具有助燃性,木炭燃烧;
假设c:红热木炭使HNO3分解产生O2,木炭与O2反应燃烧;
假设d:红热木炭使HNO3分解产生NO2和O2,共同影响木炭的燃烧;……
(4)设计实验证明假设b成立,请将实验方案补充完整。
①实验方法:_____________________________________________________。
实验现象:木炭在该气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
②根据实验现象写出木炭与此气体反应的化学方程式__________________。
Ⅱ.设计硝酸在不同条件下分解实验,方案见下表:
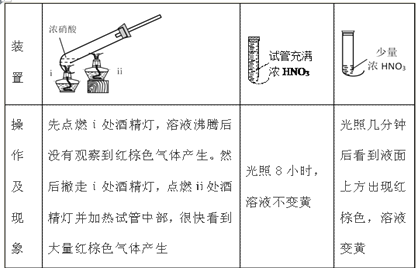
(5)分析上述现象,得出使硝酸成功分解的关键是____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
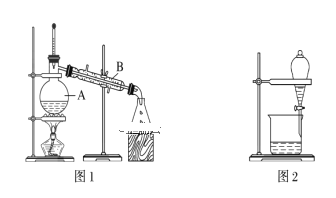
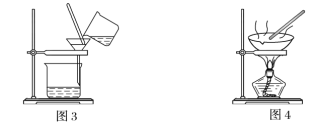
(1)装置图1中B的名称是________________,图2中漏斗的名称是________________。A中一般要加入碎瓷片,其作用是_______________________。下列关于以上实验操作说法一定正确的是_____。
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度
D.图4实验中,当加热至有较多固体析出时,即停止加热
(2)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离可选用上图中的图________________所示仪器。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)与16gO2所含原子总数相同的NH3标准状况下体积是________L;
(2)已知2L Al2(SO4)3溶液中c(Al3+)=3mol/L,它与3L__________mol/LNa2SO4中SO42-的物质的量浓度相等。
(3)同温同压下:同体积的NH3和H2S气体的质量比为_____________;同质量的NH3和H2S气体的体积比为___________,其中含有的氢的原子个数比为________;若NH3和H2S中的氢原子数相等,它们的体积比为____________。
(4)在标准状况下,8.96L的CH4和CO的混合气体,混合气体对氢气相对密度是9.5,则混合气体中CH4的体积为____________,CH4和CO原子个数比为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com