
科目: 来源: 题型:
【题目】在如图所示的物质相互转化关系中,A是一种固体单质,E是一种白色不溶于水的物质。据此填空。
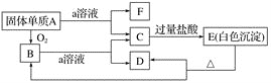
(1)写出各物质的化学式:
A.________、B________、C________、
D.________、E________、F________。
(2)B与a溶液反应的离子方程式是_________。
(3)A与a溶液反应的离子方程式是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,向A室中充入H2和O2的混合气体,向B室中充入3mol空气,此时活塞的位置如图所示:

(1)A室混合气体的物质的量为__________,标准状况下的体积为_____________L ;
(2)实验测得A室混合气体的质量为102g,则该混合气体的密度是同温同压条件下氢气密度的 ______________倍;
(3)若将A室中H2与O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在_______ 刻度,容器内气体压强与反应前气体压强之比为 _____________.
查看答案和解析>>
科目: 来源: 题型:
【题目】以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
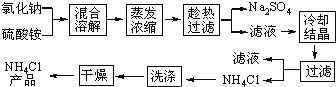
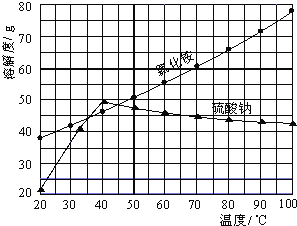
氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)欲制备10.7gNH4Cl,理论上需NaCl_________g。
(2)实验室进行蒸发浓缩用到的主要仪器有________、烧杯、玻璃棒、酒精灯等。
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为_________。
(4)不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是_________________。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中含H+、SO42-、NO3-三种离子,其中H+、SO42-的物质的量浓度分别为7.0 mol·L-1和2.0 mol·L-1。取该溶液20 mL,加入3.2 g铜粉,加热使它们充分反应,产生的气体在标准状况下的体积约为( )
A. 0.75 LB. 0.336 LC. 1.5 LD. 0.448 L
查看答案和解析>>
科目: 来源: 题型:
【题目】避蚊酯(DMP)是一种塑化剂,相对分子质量为194,摄人后对人体有一定的危害,其结构可表示为![]() (其中R为烃基)实验室由以下方法可得到DMP。
(其中R为烃基)实验室由以下方法可得到DMP。
![]()
请回答:
(1)物质C中官能团的名称为_____。
(2)下列有关DMP的说法可能正确的是_______。(填字母标号)
A.DMP的分子式为C10H12O4
B.DMP可以发生取代、加成、氧化等反应
C.DMP在水中的溶解度不大
(3)B与乙二酸(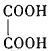 )在一定条件下可以按物质的量1:1发生反应生成高分子化合物,该高分子化合物的结构简式为______。
)在一定条件下可以按物质的量1:1发生反应生成高分子化合物,该高分子化合物的结构简式为______。
(4)工业上以邻二甲苯(![]() )为原料先生产苯酐(
)为原料先生产苯酐(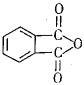 ),再使其与某醇在一定条件下反应制取DMP。苯酐与该醇制取DMP的化学方程式为________。
),再使其与某醇在一定条件下反应制取DMP。苯酐与该醇制取DMP的化学方程式为________。
(5)芳香化合物E与C互为同分异构体,若lmo E与足量银氨溶液反应最多生成2mol Ag,则E可能的结构简式为______。B也存在多种同分异构体,符合下列条件的B的同分异构体有______种。
①l mol有机物可以与2mol NaOH反应
②苯环上的一氯代物只有一种。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. FeCl3溶液腐蚀印刷电路铜板:Cu+Fe3+=Cu2++Fe2+
B. 醋酸溶解鸡蛋壳:2H++CaCO3=Ca2++CO2↑+H2O
C. 在NaHSO4溶液中滴入Ba(OH)2溶液至溶液呈中性:Ba2++2OH-+2H++SO![]() =BaSO4↓+2H2O
=BaSO4↓+2H2O
D. 在NaHCO3溶液中滴入少量澄清石灰水:HCO![]() +Ca2++OH-=CaCO3↓+H2O
+Ca2++OH-=CaCO3↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能。
(1)写出基态Mn原子的核外电子排布式________________________。
(2)CoTiO3晶体结构模型如图1所示。在CoTiO3晶体中1个Ti原子、1个Co原子,周围距离最近的O原子数目分别为_______个、_______个。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂, 常用于污水处理。O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO- 互为等电子体的分子、离子化学式分别为______________、_______(各写一种)。
(4)三聚氰胺是一种含氮化合物,其结构简式如图所示。
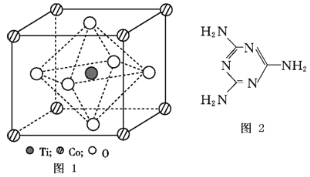
三聚氰胺分子中氮原子轨道杂化类型是______,1 mol三聚氰胺分子中σ键的数目为_______。
查看答案和解析>>
科目: 来源: 题型:
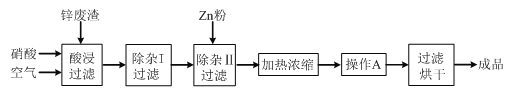
【题目】工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
⑴在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是_____________________。
⑵上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有_____。
⑶在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为_____。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为_____。检验Fe3+是否沉淀完全的实验操作是_____。
⑷加入Zn粉的作用是_____。“操作A”的名称是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】用18.4 mol·L-1的浓硫酸配制100 mL 1 mol·L-1硫酸。
(1)①应取浓硫酸的体积为__________mL,稀释浓硫酸的操作是_______________________
②若实验仪器有:A.100mL量筒;B.托盘天平;C.玻璃棒;D.50mL容量瓶;E.10mL量筒;F.胶头滴管;G.50mL烧杯;H.100mL容量瓶
实验时必须选用的仪器有(填入编号)___________。
③定容时,若不小心加水超过了容量瓶刻度线,应___________。
(2)该浓硫酸的密度为1.84g·mL-1,据此求出其溶质的质量分数___________。
(3)浓硫酸是中学常用的干燥剂。若100g该浓硫酸能吸收16g水,吸水后生成H2SO4·nH2O,则n=___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
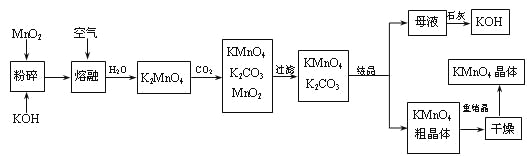
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列___(填序号)物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
___________________________________________________________________。
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是:_______。
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、___和___(写化学式)。
(5)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得_____mol KMnO4。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com