
科目: 来源: 题型:
【题目】中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。空气吹出法工艺,是目前“海水提漠”的最主要方法之一。其工艺流程如图所示,试回答下列问题:
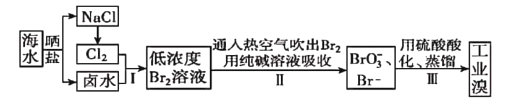
(1)以上步骤I中已获得游离态的溴,步骤II又将之转变成化合态的溴,其目的是_____。
(2)步骤②通入热空气或水蒸气吹出![]() ,利用了溴的___。
,利用了溴的___。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)流程Ⅱ中涉及的离子反应方程式如下,请在下面横线内填入适当的化学计量数:
![]() ____
____
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:____。
(5)流程Ⅲ蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】如表是元素周期表的一部分,其中每个数字编号代表一种短周期元素。
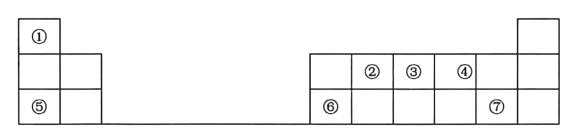
请按要求回答下列问题:
(1)元素②的元素名称是____。
(2)元素⑤处于周期表中第____周期第___族。
(3)①⑦七种元素中原子半径最大的是___(填元素符号)。②③④三种元素的最简单氢化物中最稳定的是____(填化学式)。
(4)元素③和元素⑦的氢化物均极易溶于水,且二者能反应产生大量白烟,写出该白色物质发生分解的化学方程式______。
(5)元素⑥的最高价氧化物对应的水化物是一种____性氢氧化物,该物质与元素⑦的最高价氧化物对应水化物反应的离子方程式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨的催化氧化是工业制硝酸的重要反应:4NH3+5O2![]() 4NO+6H2O,对于该反应判断正确的是
4NO+6H2O,对于该反应判断正确的是
A. 氧气被还原B. 该反应是置换反应
C. 氨气是氧化剂D. 若有17 g氨参加反应,反应中转移10 mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2
②氯气和碱的反应为放热反应。温度较高时,氯气和碱还能发生如下反应:3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
该兴趣小组设计了下列实验装置,进行实验。
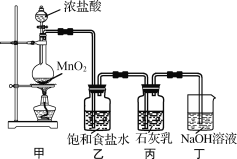
请回答下列问题:
(1)①甲装置用于制备氯气,乙装置的作用是__。
②实验室用足量NaOH溶液吸收从浓盐酸和MnO2反应体系中导出的气体。当吸收温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种。下列说法不正确的是_。(填字母)
A.若产物为NaClO3、NaCl,则参加反应的氧化剂和还原剂的物质的量之比为1∶5
B.若产物为NaClO、NaCl,则吸收后的溶液中n(NaClO)=n(NaCl)
C.若产物为NaClO、NaClO3、NaCl,则NaOH与Cl2相互反应的物质的量之比为2∶1
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,其可能原因是部分氯气未与石灰乳反应而逸出,以及温度升高。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢匀速地通入足量氯气,得出了Ca(ClO)2、Ca(ClO3)2两种物质的物质的量(n)与反应时间(t)的关系曲线,粗略表示为如图(不考虑氯气和水的反应)。
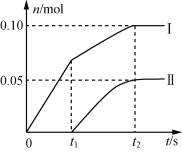
①图中曲线II表示__(填物质的化学式)的物质的量随反应时间变化的关系;
②所取石灰乳中含有Ca(OH)2的物质的量为__mol;
查看答案和解析>>
科目: 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:
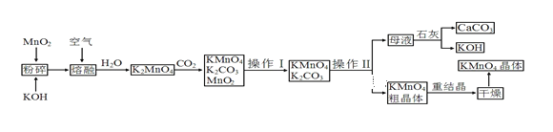
(1) KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列_____物质相似。
A 75%酒精 B 双氧水 C 苯酚 D “84”消毒液(NaClO溶液)
(2)操作Ⅰ的名称是________;
(3)上述流程中可以循环使用的物质有石灰、CO2、____,____;(写化学式)。
(4) 向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是_______。
(5) 铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋元素的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式:___________。
(6) 写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品1 L,进行了三组实验,其操作和有关图像如下所示:

请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是________,一定存在的阳离子是________。
(2)写出NH4+的电子式________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为____,所得沉淀的最大质量是___g。
(4)若通过实验确定原废水中c(Na+) =0.18 mol·L-1,试判断原废水中NO3-是否存在?________(填“存在”“不存在”或“不确定”)。若存在,c(NO3-)=________ mol·L-1。(若不存在或不确定则此空不填)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E是化学中常见的物质。常温下,E是一种无色无味的液体,它们之间有如下反应关系。
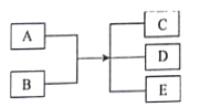
(1)若A是一种具有磁性的黑色金属氧化物,B是一种常见的非氧化性酸,A和B反应的离子方程式为__;若在生成物C中继续滴加氢氧化钠溶液,会观察到生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色,写出白色沉淀发生化学反应的方程式__。A与CO高温下反应可得到金属单质,写出该金属单质与水蒸气反应的化学方程式__。
(2)若实验室中利用固体A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜在生活中有广泛的应用。CuCl2和CuCl是两种常见的盐,广泛应用于工业生产。
I. CuCl2固体遇水易水解。实验室用如图所示的实验仪器及药品来制备纯净、干燥的氯气,并与粗铜(含杂质铁)反应制备氯化铜(铁架台、铁夹及酒精灯省略)。

(1)写出装置A中,发生反应的化学反应方程式:____,装置C的作用是____
(2)完成上述实验,按气流方向连接各仪器接口的顺序是a→___。(每种仪器限使用一次)
(3)上述D装置的作用是____
Ⅱ. CuCl是应用广泛的有机合成催化剂,可采取不同方法制取。CuCl晶体呈白色,露置于潮湿空气中易被氧化。
方法一:向上述制得的氯化铜溶液中通入SO2,加热一段时间即可制得CuCl,写出该反应的离子方程式:___。
方法二:铜粉还原CuSO4溶液
![]()
已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+2Cl-![]() [CuCl3]2-(无色溶液)。
[CuCl3]2-(无色溶液)。
(1)①中,“加热”温度不宜过高和过低,目的是___,当观察到__现象,即表明反应已经完全。
(2)②中,加入大量水的作用是___。(从平衡角度解释)
查看答案和解析>>
科目: 来源: 题型:
【题目】少量铁粉与![]() 的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变
的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变![]() 的产量,可以使用如下方法中的( )
的产量,可以使用如下方法中的( )
①加![]() ②加
②加![]() 固体 ③滴入几滴浓盐酸
固体 ③滴入几滴浓盐酸
④改用![]() 的硝酸 ⑤加
的硝酸 ⑤加![]() 溶液 ⑥滴加几滴硫酸铜溶液
溶液 ⑥滴加几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发) ⑧改用![]() 的盐酸
的盐酸
A. ③⑤⑥⑦B. ③⑦⑧C. ③⑥⑦⑧D. ③④⑥⑦⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色透明溶液中只可能大量存在NH4+、Na+、Ag+、Ba2+、MnO4-、Fe3+、CO32-、SO42-、NO3-中的几种离子。从其中取两份各100mL,进行如下实验:
(1)不做任何实验就可以肯定原溶液中不存在的两种离子是__、__。
(2)取其中的一份进行实验,加入过量氢氧化钠溶液并加热,生成气体0.06mol。另取其中的一份加入过量Ba(NO3)2溶液,生成白色沉淀4.30g,过滤,向沉淀中再加入过量稀盐酸,沉淀部分消失,余下沉淀2.33g。综上所述说明原溶液中肯定存在的各离子浓度分别是(下面填写要求:例如c(Na+)=0.1mol/L)__、__、__、__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com