
科目: 来源: 题型:
【题目】氯中存在如下平衡:Cl2(g) Cl2(aq)、Cl2(aq)+H2O H++Cl-+HClO。下列说法正确的是( )
A.向饱和氯水中通入HCl,有c(H+)=c(Cl-)+c(OH-)+c(ClO-)
B.向氯水中滴入几滴石蕊试液,溶液变红色
C.光照后的氯水漂白性增强
D.若向饱和氯水中通入少量SO2,则![]() 减小
减小
查看答案和解析>>
科目: 来源: 题型:
【题目】下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )
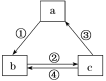
选项 | a | b | c | 箭头上所标数字的反应条件 |
A | AlCl3 | NaAlO2 | Al(OH)3 | ①加入过量的NaOH |
B | Si | SiO2 | H2SiO3 | ②常温加水 |
C | NaOH | NaHCO3 | Na2CO3 | ③加澄清石灰水 |
D | Fe | FeCl3 | FeCl2 | ④加入氯气 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.0.1molSiO2晶体中含有的Si—O键的数目为0.2NA
B.18gH218O和D2O的混合物中,所含电子数目为9NA
C.标准状况下,22.4LCl2溶于水,转移的电子数为NA
D.56g铁粉与足量高温水蒸汽完全反应,生成的H2数目为1.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列反应的方程式,并注明氧化剂、还原剂、氧化产物。
①用CO还原Fe2O3炼铁,化学方程式:___________________________________。氧化剂:__________,还原剂____________
②曾青(CuSO4)得铁化为铜的离子方程式:______________________________.
氧化剂: ____________,氧化产物_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】计算:
(1)同温同压下,等质量的SO2气体和CO气体密度之比为________;体积比为________;原子个数比为________。
(2)某混合溶液中只含有下列几种离子:Na+、Mg2+、Al3+、Cl-、SO42-,若Na+、Mg2+、Cl-、SO42-的物质的量浓度依次为0.2mol/L、0.25mol/L、0.5mol/L、0.25mol/L,则c(Al3+)=________。
(3)在标准状况下,某混合气体密度是2.86gL-1,该混合气体的平均相对分子质量是________;现有质量比为11:7的CO2和CO的混合气体,该混合气体的摩尔质量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常用水钴矿(主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、CaO等杂质)制备钴的氧化物,其制备工艺流程如下(已知Na2SO3能还原Fe3+和Co3+):

回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有______________(任写2种)。
(2)“酸浸”后加入Na2SO3钴的存在形式为Co2+,产生Co2+反应的离子方程式为________
(3)溶液a中加入NaClO的作用是___________________________________
(4)沉淀a的成分是__________(写化学式),操作2的名称是_______________
(5)溶液d中的金属离子只有Co2+和Na+两种,则溶液c中加入NaF溶液的作用是________
(6)在空气中缎烧CoC2O4生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05g,CO2的体积为6.72L(标准状况),则此反应的化学方程式为____________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】有X、Y、Z、Q、T五种元素,X原子的M层p轨道有2个未成对电子,Y原子的外围电子构型为3d64s2,Z原子的L电子层的p能级上有一空轨道,Q原子的L电子层的p能级上只有1对成对电子,T原子的M电子层上p轨道半充满。试回答下列问题:
(1)X的元素符号__________,Y的元素符号________。
(2)Z元素原子的电子排布式_______,Q元素原子的电子排布图__________,T元素原子的电子排布图_______________________________。
(3)Y的单质在Q的单质中燃烧的化学方程式:_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列仪器为某些基本操作的部分仪器,请按照要求填空:
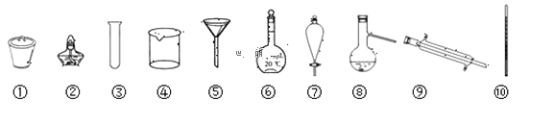
(1)写出仪器的名称:①________;⑦________;⑧________;
(2)上述仪器中,可以直接加热的仪器有________(填序号)。
(3)分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃),需要上述仪器中的(填序号)________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p轨道的电子数等于次外层的电子总数,B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。根据以上条件,回答下列问题:
(1)画出C的原子结构示意图:________。
(2)写出D原子的外围电子排布式:________。
(3)写出A元素单质在B中完全燃烧的化学方程式:______________。
(4)指出E元素在元素周期表中的位置:____________。
(5)比较A、B、C三种元素的第一电离能的大小顺序:________________(按由大到小的顺序排列,用元素符号表示)。
(6)比较元素D和E的电负性的相对大小:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下均呈气态;Y的原子最外层电子数是其电子层数的2倍;M与X同族;Z、G分别是地壳中含量最高的非金属元素和金属元素。回答下列问题:
(1)Y、Z、M、G四种元素的原子半径由大到小的顺序是____________ (用元素符号表示)。
(2)Z在元素周期表中的位置为____________,M2Z的电子式为____________。
(3)上述元素的最高价氧化物对应的水化物中,酸性最强的水化物是__________(写化学式)。
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且它的产量可以用来衡量一个国家的石油化工发展水平的是____________ (写名称)。
(5)GQ3溶液与过量的MZX溶液反应的化学方程式为_________________________________
(6)常温下,不能与G的单质发生反应的是____________ (填标号)。
a.CuSO4溶液 b.浓硫酸 c.NaOH溶液 d.浓硝酸 e.氧化铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com