
科目: 来源: 题型:
【题目】有关物质的转化关系如下图所示。A、C、E是常见的金属单质,E为紫红色,反应①可用于焊接铁轨,B是赤铁矿的主要成分,F的溶液中加入KSCN溶液变红。(部分反应物和生成物省略)
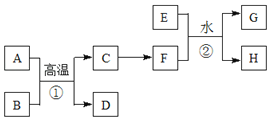
请回答下列问题:
(1)B的化学式是____________D的化学式是_____________
(2)可选用__________(填“字母”)实现反应C→F的转化。
a.稀盐酸 b.氯气/点燃 c.CuSO4溶液
(3)反应①的化学方程式为___________________________。
(4)反应②的离子方程式为___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中投入一定量的A和B发生反应:mA(g)+nB(g)![]() pC(g)+qD(g)。
pC(g)+qD(g)。
(1)若开始时加入A物质m mol,欲使A与B的转化率相等,则加入B物质________mol。
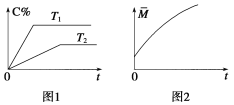
(2)相同的压强下,充入一定量的A、B后,在不同温度下C的百分含量与时间的关系如图1所示。则T1(填“>”、“<”或“=”)______T2,该反应正反应方向的ΔH(填“>”、“<”或“=”)______0。
(3)一定条件下,从正反应开始至达到化学平衡的过程中,混合气体的平均相对分子质量随时间的变化如图2所示,测得达到平衡时A、B、C、D的物质的量均为1 mol。
①若在恒温恒容的条件下,向该平衡体系中再通入A、B、C、D各1 mol,则体系中气体的平均相对分子质量(填“增大”、“减小”、“不变”或“无法确定”)__________。
②若恒温恒压的条件下,向原平衡体系中再通入A、B、C、D各1 mol,则体系中气体的密度(填“增大”、“减小”、“不变”或“无法确定”)__________。
查看答案和解析>>
科目: 来源: 题型:
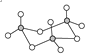
【题目】(1)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,从电子云重叠方式看共价键的类型有________种;固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(2)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为__。
图1 FexNy晶胞结构示意图 图2转化过程的能量变化
图2转化过程的能量变化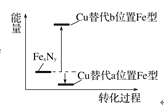
(3)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446 nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为__ nm,与K紧邻的O个数为____。
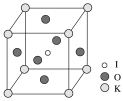
(4)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于_______位置,O处于______位置。
查看答案和解析>>
科目: 来源: 题型:
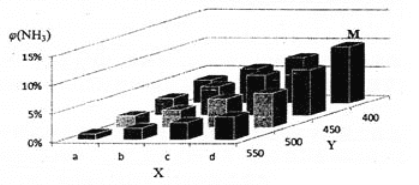
【题目】1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才。现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟哈伯合成氨的工业化生产: N2(g) +3H2(g) ![]() 2NH3(g)△H < 0 当改变某一外界条件(温度或压强)时,NH3的体积分数φ(NH3)变化趋势如下图所示。
2NH3(g)△H < 0 当改变某一外界条件(温度或压强)时,NH3的体积分数φ(NH3)变化趋势如下图所示。
(1)已知:①NH3(l) ![]() NH3(g) ΔH1 ②N2(g)+3H2(g)
NH3(g) ΔH1 ②N2(g)+3H2(g) ![]() 2NH3(l) ΔH2,则反应N2(g)+3H2(g)
2NH3(l) ΔH2,则反应N2(g)+3H2(g) ![]() 2NH3(g)的△H=________(用含△H1、△H2的代数式表示)。
2NH3(g)的△H=________(用含△H1、△H2的代数式表示)。
(2)X轴上a点的数值比b点 _____(填“大”或“小”),Y轴表示_______(填“温度”或“压强”)。
(3)将1mol N2和3mol H2分别投入起始容积为1L的密闭容器中,实验条件相关数据如下表所示:
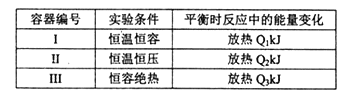
下列判断正确的是________。
A.放出热量:Ql< Q2<|△H| B.N2的转化率:I> III
C.平衡常数:II >I D.达平衡时氨气的体积分数:I>II
(4)平衡时,M点NH3的体积分数为10%。若同温同容下,再充入0.2mol N2,0.6mol H2和1.6molNH 3,重新达平衡时NH3的体积分数________ 10%(填“>”、“<”、“=”或“无法确定”)。
(5)某科研小组探究在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响.实验结果如图所示:(图中T2和T1表示温度,n表示起始时H2的物质的量)
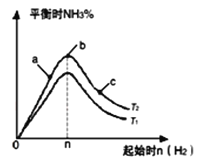
①图象中T2和T1的关系是:T2_____T1(填“>”、“<”、“=”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是___(填字母)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计了如图装置制取和验证SO2的性质。

请回答:
(1)写出装置A中发生反应的化学方程式_______________________________。
(2)棉球中NaOH 溶液的作用是_______________________________,写出该反应离子方程式_______________________________。
(3)为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是_____。
A.酸性高锰酸钾试液 B.无色酚酞试液 C.澄清石灰水 D.碘水
(4)下列说法正确的是_____。
A.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
B.先向装置中加入试剂(药品),再进行气密性检查
C.实验开始后,洗气瓶①和③中溶液均褪色,两者均可证明SO2具有漂白性
D.实验开始后,洗气瓶④中可观察到白色沉淀产生,该现象可说明SO2具有还原性
(5)二氧化硫排放到空气中,可形成酸雨,含亚硫酸的酸雨久置后pH_____(增大、减小或不变)。你认为减少酸雨产生的途径可采取的措施是_____。
①少用煤作燃料; ②把工厂烟囱造高; ③燃料脱硫; ④在已酸化的土壤中加石灰;⑤开发新的能源。
A.②③ B.②③⑤ C.①③⑤ D.①③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上可以从电解铜的阳极泥中提取很多重要物质,其工艺流程如下:
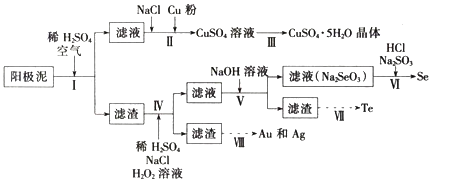
已知:①阳极泥的主要化学成分,如表所示:
主要成分 | Cu Ag Au Se Te |
百分含量/% | 23.4 12.1 0.9 6.7 3.1 |
②温度和硫酸浓度对阳极泥中各组分浸出率的影响,如表所示:
固定浸出温度 | 固定H2SO4浓度 | |||
H2SO4浓度 / mol·L-1 | 浸出率/% | 浸出温度/℃ | 浸出率/% | |
Cu Ag Au Se Te | Cu Ag Au Se Te | |||
4 | 95.1 4.67 <0.2 0.83 8.93 | 30 | 87.1 4.58 <0.2 0.08 6.83 | |
3 | 94.5 4.65 <0.2 0.28 6.90 | 40 | 94.5 4.65 <0.2 0.28 6.90 | |
2 | 78.1 2.65 <0.2 0.05 2.85 | 50 | 96.1 5.90 <0.2 0.64 8.73 |
(1)步骤I的主要目的为浸出铜,发生的主要反应的化学方程式为__________;分析表2数据,可知步骤I最适合的条件为______________。
(2)步骤II中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为________。
(3)步骤III的操作方法为___________。
(4)步骤IV中,反应温度为75℃。加入H2O2溶液作用为______________;此过程中H2O2溶液的添加量要远远高于理论值,原因为_____________。
(5)步骤VI中所发生反应的化学方程式为_______。
(6)步骤VII中,碱性环境下电解Na2TeO3溶液可得Te实现,阴极的电极反应式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】新旧动能转换工程之一是新能源新材料的挖掘和应用。乙二醇是重要的化工原料, 煤基合成气(CO、H2)间接制乙二醇具有转化率高、回收率高等优点,是我国一项拥有自主知识产权的世界首创技术,制备过程如下:
反应 I:4NO(g)+4CH3OH(g)+O2(g)![]() 4CH3ONO(g)+2H2O(g) △H1 =akJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 =akJ·mol-1
反应 II:2CO(g)+2CH3ONO(g)![]() CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
反应 III:CH3OOCCOOCH3(1)+4H2(g)![]() HOCH2CH2OH(1)+2CH3OH(g) △H3=c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g) △H3=c kJ·mol-1
(1)请写出煤基合成气[n(CO):n(H2)= 1:2]与氧气间接合成乙二醇的总热化学方程式:__,该反应在较低温条件下能自发进行,则ΔH___0(填“>”、“<”或“=”)。
(2)一定温度下,在2L的密闭容器中投入物质的量均为0.4mol的CO和CH3ONO发生反应II,10min达到平衡时CO的体积分数与NO的体积分数相等。
①下列选项能判断反应已达到化学平衡状态的是____。
a.CO的质量不再变化
b.混合气体的密度不再变化
c.单位时间内生成CO和NO的物质的量相等
d.CO和CH3ONO的浓度比不再变化
②若此时向容器中再通入0.4molNO,一段时间后,达到新平衡时NO的体积分数与原平衡时相比__(填“增大”“相等”“减小”或“不能确定”)。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____(填字母)。
a.  b.
b. 
c.  d.
d. 
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用密度为1.18g/ml,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
实际应量取盐酸体积/ml | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
______________ | ______________ | ______________ |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)______________;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是_________________________________,溶液注入容量瓶前需恢复到室温,这是因为______________________________________;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作_______________;若加蒸馏水时不慎超过了刻度_______________;若定容时俯视刻度线___________________。
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度_______________;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,在27.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.21g /cm3,求:
① 该溶液中阴阳离子的总物质的量
② 该溶液中CuSO4的物质的量浓度
③ 取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
查看答案和解析>>
科目: 来源: 题型:
【题目】碳的化合物在生产、生活中有着重要的作用。
(1)已知:2CO(g)+O2(g)![]() 2CO2(g) △H1=-566kJ·molˉ1
2CO2(g) △H1=-566kJ·molˉ1
H2O(g)+CO(g)![]() H2(g)+CO2(g) △H2=-41kJ·molˉ1
H2(g)+CO2(g) △H2=-41kJ·molˉ1
CO(g)+2H2(g)![]() CH3OH(g) △H3=-107kJ·molˉ1
CH3OH(g) △H3=-107kJ·molˉ1
则CH3OH(g)+![]() O2(g)
O2(g) ![]() CO2(g)+2H2O(g) △H=___kJ·molˉ1
CO2(g)+2H2O(g) △H=___kJ·molˉ1
(2)T℃时,向容积均为2L的A、B两个密闭容器中均通入4.0molCO2和6.8molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率 α (CO2) 随时间的变化如图所示。
CH3OH(g)+H2O(g) △H=-50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率 α (CO2) 随时间的变化如图所示。

①在0~5min内A容器中v(CH3OH)=___;该温度下上述反应的平衡常数K=___(保留两位有效数字)。
②反应开始至平衡的过程中,A、B两容器中CO2的消耗速率的大小关系为v(A)___(填“>”“<”或“=”)v(B)。
③反应过程中,下列各项指标能表明A容器中反应的v正>v逆的是___(填标号)
a.体系内的压强增大
b.气体的平均相对分子质量增大
c.断裂H-H键的数目是形成C-O键数目的2倍
d.v逆(CO2)=v正(H2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com