
科目: 来源: 题型:
【题目】甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) | K3 | ||
(1)反应②是_________(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如下图1所示。则平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”)。
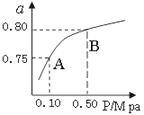
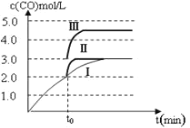
图 1 图2
(3)判断反应③△H____0; △S____0(填“>”“=”或“<”)在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol, 此时v(正)___v(逆)(填“>”“=”或“<”)
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知 c(CO)与反应时间t变化曲线Ⅰ如上图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是________。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_____________。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸.常温条件下,将amol/L的CH3COOH与bmol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为________.
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O
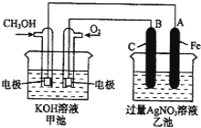
(1)请回答图中甲、乙两池的名称.甲池是 ______装置,乙池是 ______ 装置;
(2)请回答下列电极的名称:通入CH3OH的电极名称是 ______ ,B(石墨)电极的名称是 ______ ;
(3)通入O2的电极的电极反应式为: ______ ,A (Fe)电极的电极反应式为 ______ ;
(4)乙池中反应的化学方程式为 ______ ;
(5)电解一段时间后,乙池中A(Fe)极的质量增加5.4g时,且溶液的体积为500mL,求所得溶液在25℃时的pH= ______ ,甲池中消耗O2为 ______ mL(标准状况下).
(6)钴铁氧体(CoFe2O4)不仅是重要的磁性材料、磁致伸缩材料,还是重要的锂离子电池负极材料。工业上,用电化学法制得CoFe2O4。以NaOH溶液作电解液,纯净的钴铁合金(CoFe2)作阳极进行电解,在阳极上获得CoFe2O4薄膜。该电解过程的化学方程式为_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】通过测定反应过程中所放出的热量可计算中和热。50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:
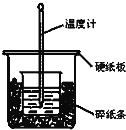
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是___________.
(2)大烧杯上如果不盖硬纸板,求得的中和热数值__________(填“偏大”,“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol/L盐酸跟50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”“不相等”),简述理由:______________________.
(4)若两溶液的密度都是1g/mL,中和后所得溶液的比热容c=4.18J/(g·℃),三次平行操作测得终止温度与起始温度差(t2﹣t1)分别为:①3.2℃ ②2.2℃ ③3.0℃,写出表示盐酸与NaOH溶液反应的中和热的热化学方程式________________________.(小数点后保留一位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2Fe2++Cl2=2Cl﹣+2Fe3+,2Br﹣+Cl2=Br2+2Cl﹣,2Fe2++Br2=2Br﹣+2Fe3+。在bL FeBr2溶液中通入amol Cl2时,使溶液中50% 的Br﹣氧化为Br2,则原FeBr2的物质的量浓度为
A. a/bmolL﹣1 B. 2a/bmolL﹣1 C. 3a/bmolL﹣1 D. 5a/bmolL﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)放出热量99kJ,请回答下列问题:
2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)放出热量99kJ,请回答下列问题:
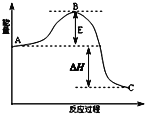
(1)图中A、C分别表示_____________、_____________.
(2)该反应通常用V2O5作催化剂,加V2O5会使图中B点_________(填“升高”,“降低”),△H_______(填“变大”,“变 小”或“不变”),理由是______________________.
(3)图中△H=________kJ/mol.
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.4gNaOH和1.069![]() 混合并配成溶液,向溶液中滴加0.1mol·
混合并配成溶液,向溶液中滴加0.1mol·![]() 稀盐酸。下列图像能正确表示加入盐酸的体积和生成
稀盐酸。下列图像能正确表示加入盐酸的体积和生成![]() 的物质的量的关系的是
的物质的量的关系的是
A.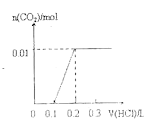 B.
B.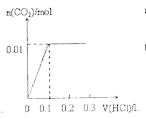
C.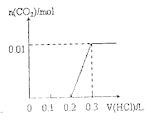 D.
D.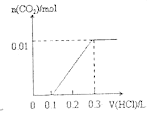
查看答案和解析>>
科目: 来源: 题型:
【题目】用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、NiO、SiO2等)制备草酸钴晶体(CoC2O4·2H2O)的流程如图:
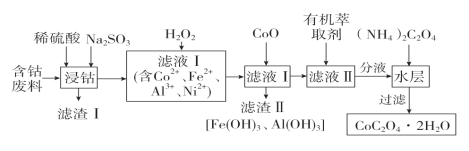
(1)滤渣Ⅰ的成分是________;浸钴时Al2O3溶解的离子方程式为__________________;Co2O3溶解的离子方程式为________________________________。
(2)滤液Ⅰ加入H2O2的目的是________________________________________;加入CoO产生Fe(OH)3和Al(OH)3的原因是_________________________________________;若要将滤液Ⅰ中Fe3+和Al3+全部沉淀,则应将滤液Ⅰ的pH控制在_____________。(已知:溶液中离子浓度小于1×10-5 mol·L-1,则认为离子完全沉淀;Ni(OH)2、Fe(OH)3、Al(OH)3的Ksp分别为1×10-15、1×10-38、1×10-32)
(3)加入有机萃取剂的目的是_______________________________。
(4)加入(NH4)2C2O4反应的离子方程式为___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g) ![]() 2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。请回答下列问题:
2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。请回答下列问题:

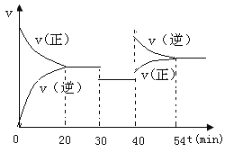
(1)0~20min,A的平均反应速率为_________________;8min时,v(正)___v(逆)(填:>、=或<)
(2)反应方程式中的x=_______,30min时改变的反应条件是________________________。
(3)20~30min时反应的平衡常数_______30~40min时反应的平衡常数(填:>、=或<)。
(4)该反应的正反应为________(填:“放热”或“吸热”)反应。
(5)反应过程中B的转化率最大的时间段是__________________min。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是
A.pH=1的NaHSO4溶液:![]()
B.含有AgCl和AgI固体的悬浊液:![]()
C.pH相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液中:![]() 大小顺序:①>②>③
大小顺序:①>②>③
D.含等物质的量的NaHC2O4和Na2C2O4的溶液(H2C2O4为二元弱酸):![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,取浓度均为0.1molL-1的醋酸溶液和氨水溶液各20mL,分别用0.1molL-1NaOH溶液、0.1molL-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是
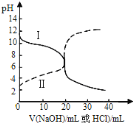
A.曲线Ⅰ:滴加溶液到10mL时![]()
B.曲线Ⅱ:滴加溶液到20mL时:![]()
C.根据滴定曲线,可得![]()
D.由曲线Ⅱ可知,选用酚酞和选用甲基橙作指示剂,消耗NaOH溶液的体积相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com