
科目: 来源: 题型:
【题目】Li-SOCl2电池采用LiAlCl4的SOCl2溶液为电解质溶液,是目前比能量最高的化学电源,具有电压高.储存寿命长.工作温度范围宽.成本低等优点。
(1)该电池的工作原理为:4Li+2SOCl2=4LiCl↓+SO2↑+S↓,该反应的还原产物为__________,若生成标准状况下气体11.2L,则转移电子的数目为_____________;
(2)SOCl2可用于AlCl3·6H2O制备无水AlCl3,请结合离子方程式解释不采用直接加热晶体的方法除去结晶水的原因_____________________________________________________________;
(3)解释Li-SOCl2电池组装必须在无水条件下的原因_______________________________;
(4)工业制硫酸中,SO2的催化氧化采用常压而不是高压的原因______________________;
(5)向NaOH溶液中缓慢通入SO2至过量,反应过程中某微粒X的物质的量浓度随着通入SO2体积的变化如图所示,该微粒X为_____________,SO2过量时溶液仍然存在微粒X的原因____________________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】氮化镓(![]() )材料具有低的热产生率和高的击穿电场,是制造大功率和高频微波电子器件的理想半导体材料。
)材料具有低的热产生率和高的击穿电场,是制造大功率和高频微波电子器件的理想半导体材料。
已知:①Ga和Al同主族且相邻,化学性质与铝相似;②在室温下,氮化镓不溶于水,硬度高,熔点高,能与热的碱溶液缓慢反应。
(1)配平氮化镓制备的化学方程式:□Ga(l)+□NH3(g)□GaN(s)+□H2(g)+QkJ(Q>0)_____________
(2)上述反应的平衡常数表达式K=_____________;在恒温恒容密闭容器中制备氮化镓,下列有关说法正确的是_____________
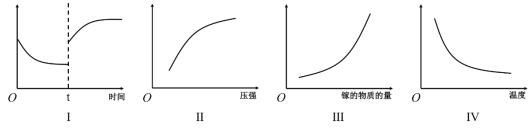
A.Ⅰ图像中如果纵坐标为正反应速率,则t时刻改变的条件可能是加压
B.Ⅱ图像中纵坐标可以为镓的转化率
C.Ⅲ图像中纵坐标可以为化学反应速率
D.Ⅳ图像中纵坐标可以为平衡常数
(3)Ga最外层电子的核外电子排布式___________________,N核外能量最高的电子亚层上电子云空间伸展方向有_____________种;
(4)氮化镓的晶体类型_____________,氮化铝和氮化镓晶体类型相同,且结构相似,比较两者熔点的高低并解释原因_____________________________________________________________;
(5)写出氮化镓溶于热的NaOH溶液的离子方程式____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下向某浓度的氯水中逐滴滴入Na2SO3溶液,无气体逸出,溶液pH变化如图所示,下列关系正确的是
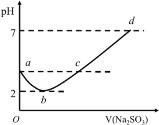
A.a点:c(H+)>c(Cl-)>c(ClO-)
B.b点:c(Cl-)=c(SO42-)=0.005mol·L-1
C.c点:c(Na+)=2c(HSO3-)+2c(SO32-)+2c(SO42-)
D.d点:c(Na+)=c(Cl-)+2c(SO32-)+2c(SO42-)
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学探究小组利用以下装置制取并探究氨气的性质。[已知生石灰与水反应生成Ca(OH)2并放出热量,实验室利用此原理往生石灰中滴加浓氨水,可以快速制取氨气。部分夹持仪器已略去]
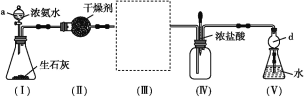
(实验探究)
(1)装置(Ⅰ)中生石灰的化学式为________,仪器a的名称是_____。
(2)装置(Ⅱ)中的干燥剂可选用____(填“碱石灰”或“浓硫酸”)。
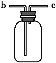
(3)在装置(Ⅲ)连接如图所示的装置,用于收集氨气(已知氨气的密度小于空气),氨气应从导管口_____(填“b”或“c”)通入集气瓶中。
(4)当实验进行一段时间后,挤压装置(Ⅳ)中的胶头滴管,滴入1~2滴浓盐酸,可观察到瓶内产生大量的______(填“白烟”或“白雾”),写出NH3与HCl反应的化学方程式:___________。
(5)装置(Ⅴ)中仪器d的作用是_______。取装置(Ⅴ)中的少量氨水于试管中,滴入1~2滴酚酞试液,溶液显____(填“无色”或“红色”),其原因是_______。
(知识应用)
(6)液氨可作制冷剂是由于液氨汽化时_____(填“吸收”或“放出”)大量的热,使周围环境的温度降低。
(7)氨气是工业制硝酸的原料,其第一步反应为4NH3+5O2![]() 4NO+6H2O,在该反应中氮元素的化合价____(填“升高”或“降低”),氨气表现出_____(填“氧化性”或“还原性”)。
4NO+6H2O,在该反应中氮元素的化合价____(填“升高”或“降低”),氨气表现出_____(填“氧化性”或“还原性”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】电子工业上常用氯化铁溶液做印刷电路铜板的腐蚀液,使用过的腐蚀废液中的金属离子主要有Fe3+、Fe2+和Cu2+。化学兴趣小组设计如下流程对废液进行处理并回收氯化铁溶液。
![]()
(1)步骤(Ⅰ)中加入H2O2溶液的目的是将Fe2+___(填“氧化”或“还原”)成Fe3+;取少量溶液A于试管中,滴入1~2滴KSCN溶液,溶液显___(填“红色”或“蓝色”)。
(2)步骤(Ⅱ)中分离溶液B和沉淀的操作名称是___;该操作需用到的玻璃仪器有烧杯、普通漏斗和___。
(3)写出步骤(Ⅲ)中Fe(OH)3与稀盐酸反应的化学方程式:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究Na2O2与H2O的反应,进行了如下实验:
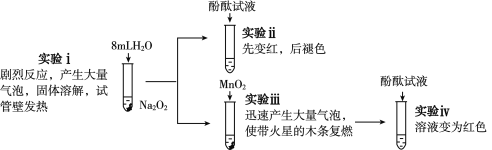
有关说法不正确的是( )
A.实验ⅰ中发生反应的化学方程式为2Na2O2+2H2O===4NaOH+O2↑
B.实验ⅲ中MnO2做H2O2分解反应的催化剂
C.综合实验ⅰ和ⅲ可以说明Na2O2与H2O反应有H2O2生成
D.综合实验ⅱ和ⅲ可以说明使酚酞褪色的是O2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学与生产.生活相关的说法正确的是
A.生铁、青铜等合金比纯金属耐腐性强
B.石油主要由各种烃组成的混合物,可以通过分馏的方法分离出C8H18
C.分离工业合成氨产品的方法是将氨气液化
D.氨的催化氧化的适宜条件为高温、高压、催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】如表是元素周期表的一部分,根据表中给出的10种元素,按要求作答。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | N | O | F | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)金属性最强的元素是_______;
(2)F的原子结构示意图是________;
(3)地壳中含量最多的元素是_______;
(4)Ne原子的最外层电子数是_______;
(5)N与O原子半径较大的是_______;
(6)H2S与HCl热稳定性较弱的是______;
(7)Na2O与MgO难与水反应的是______;
(8)Mg(OH)2与Al(OH)3能与强碱反应的是______;
(9)用于制造光导纤维的物质是______(填“Si”或“SiO2”);
(10)次氯酸(HClO)具有杀菌漂白作用,其中Cl元素的化合价为____,HClO不稳定,易分解生成HCl和O2,写出其在光照条件下分解的化学方程式:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. H2+Cl2![]() 2HCl
2HCl
B. CuO+H2SO4=CuSO4+H2O
C. 2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
D. MgCl2+2NaOH=Mg(OH)2↓+2NaCl
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置可用于收集SO2并验证其某些化学性质,关于该实验的现象和结论描述有误的是
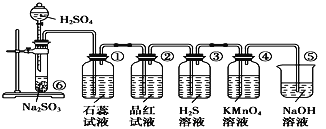
A.①中石蕊试液先变红后褪色,说明SO2溶于水呈酸性且有漂白性
B.②中品红溶液褪色,说明SO2有漂白性
C.③中硫化氢水溶液变浑浊,说明SO2有氧化性
D.④中酸性KMnO4溶液褪色,说明SO2有还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com