
科目: 来源: 题型:
【题目】西他沙星是一种广谱喹诺酮类抗菌药,可用于治疗严重的感染性疾病。一种合成西他沙星中间体![]() 的合成路线如下图所示:
的合成路线如下图所示:
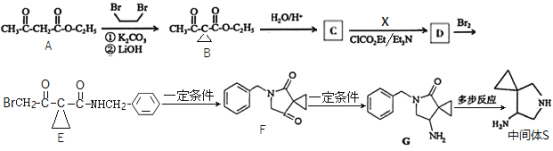
回答下列问题:
(1)![]() 的化学名称是__________。
的化学名称是__________。
(2)![]() 的结构简式为__________,
的结构简式为__________,![]() 生成
生成![]() 的反应类型是__________。
的反应类型是__________。
(3)![]() 生成
生成![]() 的化学方程式为_________________________________。
的化学方程式为_________________________________。
(4)X的同分异构体中,与X含有相同的官能团,且含苯环的有__________种(不考虑立体异构,![]() 除外);其中,核磁共振氢谱峰面积比为3:2:2:2的物质结构简式为__________(写化学式)。
除外);其中,核磁共振氢谱峰面积比为3:2:2:2的物质结构简式为__________(写化学式)。
(5)写出![]() 为原料制备
为原料制备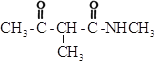 的合成路线:__________(其他试剂任选)。
的合成路线:__________(其他试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的______。(填序号)
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
(2)下列可以证明H2(g)+I2(g) ![]() 2HI(g)已达平衡状态的是______。(填序号)
2HI(g)已达平衡状态的是______。(填序号)
①单位时间内生成n mol H2的同时,生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③百分含量w(HI)=w(I2) ④反应速率v(H2)=v(I2)=v(HI)
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1
⑥温度和体积一定时,生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和体积一定时,容器内气体颜色不再变化
⑨条件一定,混合气体的平均相对分子质量不再变化
(3)已知下列反应的平衡常数:①H2(g)+S(s) ![]() H2S(g),K1;
H2S(g),K1;
②S(s)+O2(g) ![]() SO2(g),K2;则反应H2(g)+SO2(g)
SO2(g),K2;则反应H2(g)+SO2(g) ![]() O2(g)+H2S(g)的平衡常数是______。(用K1,K2 的代数式表示)
O2(g)+H2S(g)的平衡常数是______。(用K1,K2 的代数式表示)
(4)已知:①2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ/mol
②2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol
则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g)的ΔH为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜片与浓硫酸反应后,铜片表面变黑,为研究该黑色物质的成分,某化学兴趣小组查阅资料得知:该黑色物质可能含CuO、CuS、Cu2S及有可能被黑色掩盖颜色的Cu2O(砖红色)。该兴趣小组通过图1所示实验流程对该黑色物质的成分进行探究,其中步骤![]() 在图2装置中进行。
在图2装置中进行。
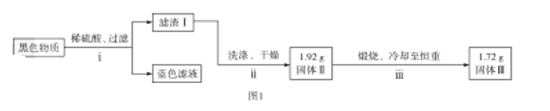
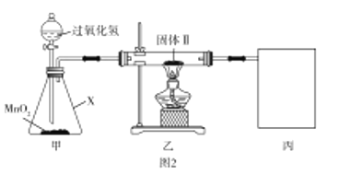
已知:Cu2O在酸中不稳定,生成Cu2+和Cu;铜的硫化物难溶于稀硫酸。回答下列问题:
(1)若测得滤渣Ⅰ中含Cu,写出“黑色物质”中加入稀硫酸发生反应生成Cu的离子方程式:__________。
(2)检验图2中整套装置气密性的方法是__________,仪器![]() 的名称是__________。
的名称是__________。
(3)步骤![]() 中检验固体Ⅱ洗涤干净的方法是__________。
中检验固体Ⅱ洗涤干净的方法是__________。
(4)通过计算确定固体Ⅱ中一定存在的硫化物是__________(写化学式)。
(5)为防止环境污染,丙装置可选用下列装置中的__________(填标号)
a.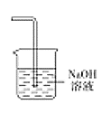 b.
b.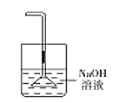 c.
c.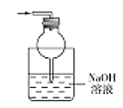 d.
d.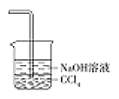
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,某绝热恒容密闭容器中的反应2N2O5(g) ![]() 4NO2(g)+O2(g) ΔH>0达到平衡状态,下列有关该状态时的说法中正确的是
4NO2(g)+O2(g) ΔH>0达到平衡状态,下列有关该状态时的说法中正确的是
A. N2O5,NO2,O2分子个数比为 2∶4∶1B. 混合气体的密度不再改变
C. 体系温度不再改变D. N2O5已全部转化为NO2和O2
查看答案和解析>>
科目: 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O
2N2(g)+3H2O![]()
在恒容的密闭容器中,下列有关说法正确的是
A. 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是被广泛应用的金属之一,铜器件在空气中久置会生成铜锈:
是被广泛应用的金属之一,铜器件在空气中久置会生成铜锈:![]() 。回答下列问题:
。回答下列问题:
(1)![]() 元素在元素周期表中的位置为________,基态
元素在元素周期表中的位置为________,基态![]() 原子的核外电子排布式为________,基态
原子的核外电子排布式为________,基态![]() 有________个未成对电子。
有________个未成对电子。
(2)参与生成铜锈的物质![]() 中
中![]() 原子的杂化方式为________,
原子的杂化方式为________,![]() 分子的空间构型是________。
分子的空间构型是________。
(3)![]() 的晶体类型是________,
的晶体类型是________,![]() 含________
含________![]() σ键。
σ键。
(4)![]() 、
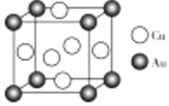
、![]() 可形成金属互化物,其晶胞结构如图所示,若该
可形成金属互化物,其晶胞结构如图所示,若该![]() 、
、![]() 金属互化物的密度为
金属互化物的密度为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]() ,则晶胞边长
,则晶胞边长![]() =________nm;
=________nm;
(5)金属铜单独与氨水或过氧化氢均不能反应,但可与过氧化氢和过量氨水的混合溶液反应生成一种配位化合物,其反应的化学方程式可表示为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目: 来源: 题型:
【题目】铜铁是目前人们使用量最大的合金材料,铁及其化合物也是人们日常生活中应用广泛的一类物质。回答下列问题:
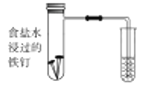
(1)下图中铁钉发生的电化学腐蚀类型是________,负极反应式为__________。
(2)实验室配置![]() 溶液时,需向溶液中滴加几滴稀硫酸,其目的是__________,
溶液时,需向溶液中滴加几滴稀硫酸,其目的是__________,![]() 溶液中离子浓度由大到小的顺序是________。
溶液中离子浓度由大到小的顺序是________。
(3)高铁盐酸是一种新型的环境消毒剂及水体净化剂,如高铁酸钾(![]() )。其中
)。其中![]() 的化合价是________,其净水过程中既表现出强氧化性,又表现了强吸附性,则
的化合价是________,其净水过程中既表现出强氧化性,又表现了强吸附性,则![]() 与水反应的离子方程式为__________。
与水反应的离子方程式为__________。
(4)羰基铁酸[![]() ]是一种二元弱酸,其第一步电离方程式为__________。
]是一种二元弱酸,其第一步电离方程式为__________。
(5)25℃时,向含![]() 的溶液中加入一定量的
的溶液中加入一定量的![]() 后,
后,![]() 恰好达到溶液平衡,测得溶液的
恰好达到溶液平衡,测得溶液的![]() ,
,![]() 。通过计算判断所得的
。通过计算判断所得的![]() 中是否含有
中是否含有![]() 杂质:________(已知:
杂质:________(已知:![]() ,
,![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物与工农业生产及人们的日常生活密切相关。回答下列问题:
(1)利用某废铜下脚料(主要成分是![]() )可制备硫酸铜晶体(蓝矾),制备方法如图所示:
)可制备硫酸铜晶体(蓝矾),制备方法如图所示:
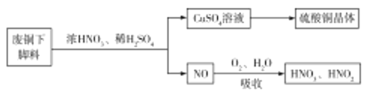
①蓝矾的化学式为:____________。
②废铜与浓硝酸,稀硫酸反应的化学方程式为______________。
(2)工业上制备尿素的反应是:![]() 。一定温度下,在容积为
。一定温度下,在容积为![]() 的恒溶液密闭容器中加入
的恒溶液密闭容器中加入![]() 和
和![]() ,反应过程中有关物质的物质的量(n)与时间的关系如图所示,
,反应过程中有关物质的物质的量(n)与时间的关系如图所示,![]() 是反应达到平衡状态。
是反应达到平衡状态。
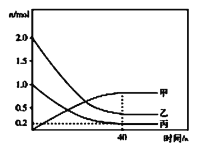
①曲线甲表示的物质是__________(写化学式)。反应开始至达到平衡时,平均反应速率![]() __________
__________![]() ,
,![]() 的平衡转化率是__________。
的平衡转化率是__________。
②升高温度,平衡__________(填“不移动”“向正反方向移动”或“向逆反应方向移动”,下同);及时从容器中分离出尿素,平衡__________。
(3)用![]() 电极作阳极可处理酸化后的亚硝酸盐污水,使
电极作阳极可处理酸化后的亚硝酸盐污水,使![]() 转化为无害气体,且溶液逐渐变为黄色,则
转化为无害气体,且溶液逐渐变为黄色,则![]() 转化为无害气体的离子方程式为__________。
转化为无害气体的离子方程式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,两种钠盐![]() 、
、![]() 溶液的物质的量浓度均为
溶液的物质的量浓度均为![]() ,加水稀释时溶液的
,加水稀释时溶液的![]() 与稀释倍数的对数
与稀释倍数的对数![]() 的关系如图所示。下列判断错误的是( )
的关系如图所示。下列判断错误的是( )
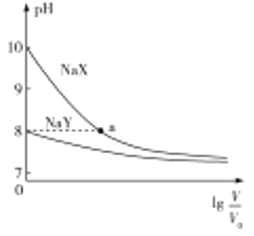
A.![]() 、
、![]() 均为弱酸,且
均为弱酸,且![]() 的酸性比
的酸性比![]() 的强
的强
B.![]() 的
的![]() 、
、![]() 溶液中,前者对水的电离促进作用较大
溶液中,前者对水的电离促进作用较大
C.![]() 点
点![]() 溶液中存在:
溶液中存在:![]()
D.随着溶液的稀释,![]() 溶液中
溶液中![]() 逐渐减小
逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com