
科目: 来源: 题型:
【题目】在同温同压下,下列各组热化学方程式中Q2 > Q1的是( )
A. 2H2(g)+O2(g)=2H2O(l) ΔH== -Q1 2H2(g)+O2(g)=2H2O(g) ΔH== - Q2
B. S(g)+O2(g)=SO2(g) ΔH== - Q1 S(s)+O2(g)=SO2(g) ΔH== - Q2
C. C(s)+![]() O2(g)=CO(g) ΔH== - Q1 C(s)+O2(g)=CO2(g) ΔH== - Q2
O2(g)=CO(g) ΔH== - Q1 C(s)+O2(g)=CO2(g) ΔH== - Q2
D. H2(g)+Cl2(g)=2HCl(g) ΔH== - Q1 ![]() H2(g)+
H2(g)+![]() Cl2(g)= HCl(g) ΔH== - Q2
Cl2(g)= HCl(g) ΔH== - Q2
查看答案和解析>>
科目: 来源: 题型:
【题目】葡萄酒中常加入亚硫酸盐作为食品添加剂,为检测某葡萄酒样品中亚硫酸盐的含量(通常以酒样中SO2的量计),某研究小组设计了如下实验(已知还原性:SO32->I->Cl-)。下列说法不正确的是
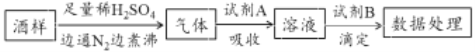
A. 葡萄酒中加亚硫酸盐的主要目的是防止氧化,利用了亚硫酸盐的还原性
B. 通入N2和煮沸的目的是为了将产生的气体从溶液中全部赶出
C. 若试剂A选择氯水,则试剂B可选择NaOH标准液
D. 若试剂A选择碱液,调节吸收后溶液为中性,则试剂B可选择I2标准液
查看答案和解析>>
科目: 来源: 题型:
【题目】某烃A 0.2 mol在氧气中充分燃烧后,生成化合物B、C各1.2 mol,试完成下列问题:
(1)烃A的分子式为____。
(2)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则此烃A的结构简式为_____。
(3)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A所有可能的结构简式分别为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应2CH3OH(g)CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是
A.a = 1.64
B.此时刻正反应速率大于逆反应速率
C.若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率增大
D.若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:① 2C(s)+O2(g)=2CO(g);ΔH= -220kJ·mol-1
② 氢气燃烧的能量变化示意图:
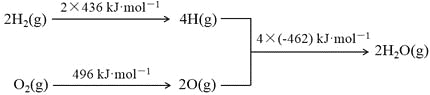
下列说法正确的是
A.1mol C(s)完全燃烧放出110 kJ的热量
B.H2(g)+1/2O2(g)=H2O(g);ΔH= -480kJ·mol-1
C.C(s)+H2O(g)=CO(g)+H2(g);ΔH= +130kJ·mol-1
D.欲分解2mol H2O(l),至少需要提供4×462kJ的热量
查看答案和解析>>
科目: 来源: 题型:
【题目】铝自然形成的氧化膜易脱落。以硫酸为电解液,分别以石墨和铝材作阴、阳极材料,经过电解处理形成氧化铝膜,抗蚀能力强。其制备的简要流程如图所示。下列用来解释流程中反应的方程式不正确的是
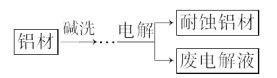
A. 碱洗目的是除去铝材表面的自然氧化膜:2OH-+Al2O3===2AlO2-+H2O
B. 碱洗时铝材表面会出现气泡:2Al+2OH-+2H2O===2AlO2-+3H2↑
C. 获得耐蚀铝材的电极反应:4Al-12e-+3O2===2Al2O3
D. 用稀氨水洗去耐蚀铝材表面的酸:NH3·H2O+H+===NH4++H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
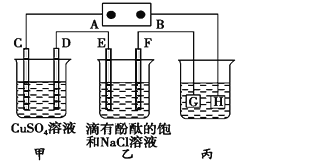
(1) A为电源的_____极,写出甲中C的电极反应式________。
(2) 若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为__。
(3) 现用丙装置给铜件镀银,电镀液是______溶液。当乙中溶液的c(OH-)=0.1 molL1时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为___。
(4) 若将F电极更换为铁,其他装置都不变,则乙中发生总反应的离子方程式是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(铝用途广泛,用铝土矿(主要成分为Al2O3·nH2O、少量SiO2和Fe2O3)制取Al有如下途径:
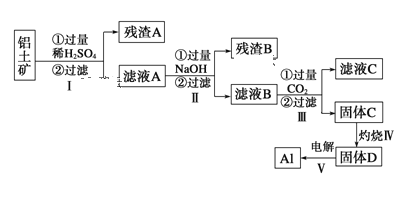
(1)滤液A加过量NaOH离子方程式表示为______________________________
(2)灼烧时盛放药品的仪器名称是_______
(3)步骤Ⅳ中发生反应的化学方程式是___________________________________
(4)步骤Ⅲ中生成固体C的离子反应方程式为_____________________________
(5)取滤液B 100mL,加入1 mol/L盐酸200 mL,沉淀量达到最大且质量为11.7g,则滤液B中c(AlO2-)____mol/L,c(Na+)____6.5 mol/L (填“大于”、“小于”或“等于”)
查看答案和解析>>
科目: 来源: 题型:
【题目】2010年,中国首次应用六炔基苯在铜片表面合成了石墨炔薄膜(其合成示意图如右图所示),其特殊的电子结构将有望广泛应用于电子材料领域。下列说法不正确的是( )
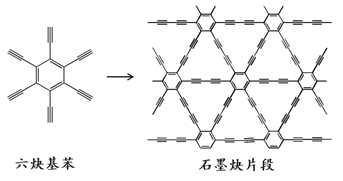
A.六炔基苯的化学式为C18H6
B.六炔基苯和石墨炔都具有平面型结构
C.六炔基苯和石墨炔都可发生加成反应
D.六炔基苯合成石墨炔属于加聚反应
查看答案和解析>>
科目: 来源: 题型:
【题目】现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:

(1)工业生产中,反应I的化学方程式是______。
(2)海水中含有大量的NaCl,以及少量的Ca2+、Mg2+、SO42等离子。
①为得到纯净的饱和NaCl溶液,进行了如下操作。请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中_______,过滤;
c.向滤液中_______,过滤;
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液。
②步骤c中反应的离子方程式有____。
(3)反应II的化学方程式是______。
(4)制得的纯碱中含有少量NaCl。取5.5g纯碱样品加入足量稀硫酸,得到标准状况下1120mLCO2。则样品中纯碱的质量分数是______%(保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com