
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4 L苯含有的分子数约为NA
B.密闭容器中23 g NO2与N2O4的混合气体中氮原子数为0.5NA
C.1 L 0.1 mol·L-1的NaHCO3溶液中,HCO3- 和CO32- 离子数之和为0.1NA
D.密闭容器中1 mol N2(g)与3 mol H2 (g)反应制备氨气,形成6NA个N-H键
查看答案和解析>>
科目: 来源: 题型:
【题目】在给定条作下,下列选项中所示的物质间转化能一步实现的是
A.Na![]() Na2O2
Na2O2![]() Na2CO3
Na2CO3
B.MgCO3![]() MgCl2溶液
MgCl2溶液![]() Mg
Mg
C.Al2O3![]() Al(OH)3
Al(OH)3![]() AlCl3
AlCl3
D.S![]() SO3
SO3![]() H2SO4
H2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是
3C(g)+4D(g)反应中,表示该反应速率最快的是
A. v(A)=0.5mol/(L·s)B. v(B)=0.3mol/(L·s)
C. v(C)=0.8mol/(L·s)D. v(D)=1.0mol/(L·s)
查看答案和解析>>
科目: 来源: 题型:
【题目】中国尿素合成塔(尿塔)使用寿命仅为欧美国家的1/4。为此北京钢铁研究院对某尿塔腐蚀过程进行研究,得出下列腐蚀机理:
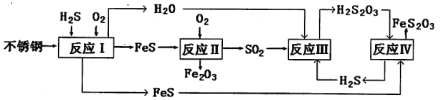
(1)H2S来自合成尿素的天然气。在380K、体积为2L的密闭容器中,存在反应:H2(g)+S(s)![]() H2S(g) △H=+21.6 kJ·mol-1。反应达到平衡时,H2、S、H2S的物质的量均为3 mol。
H2S(g) △H=+21.6 kJ·mol-1。反应达到平衡时,H2、S、H2S的物质的量均为3 mol。
①380K时该反应的化学平衡常数为__________。
②下列对该反应分析正确的是_________(填序号)。
(2)反应II的化学方程式为:____________________________________。
(3)已知室温下H2S2O3:K1=2.2×10-1,K2=2.5×10-2。
①Na2S2O3水溶液中电荷守恒式为___________________________;
②反应IV的化学方程式_____________________________________。该反应_________(填“能”或“不能”)说明FeS溶解性强于FeS2O3。
(4)此尿塔的最终腐蚀产物为__________________。为了有效防腐,北钢建议该尿塔在生产中用CuSO4溶液“脱硫(H2S)”,离子反应方程式为_________。(室温下,H2S:K1=1.3×10-7、K2=7.1×10-15。CuS:Ksp=6.3×10-36)
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,反应N2(g)+3H2(g)2NH3(g),在1L密闭容器中进行,5min内氨的物质的量增加了0.2mol,则反应速率为( )
A. v(H2)=0.015mol/(L·min)B. v(N2)=0.02mol/(L·min)
C. v(NH3)=0.17mol/(L·min)D. v(NH3)=0.01mol/(L·min)
查看答案和解析>>
科目: 来源: 题型:
【题目】某废催化剂含ZnO、ZnS、CuS和SiO2及少量的Fe3O4。
I.某同学以该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:

回答下列问题:
(1)在下图装置中,第一次浸出反应装置最合理的是____(填标号)。步骤①中发生的化学反应为非氧化还原反应,最好在(填设备名称)____中进行。
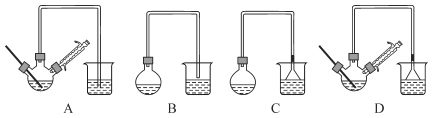
(2)滤液1中含有Fe2+,选用提供的试剂进行检验,检验方法为(提供的试剂:K3[Fe(CN)6]溶液、稀盐酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水)____。
(3)步骤③中发生反应的离子方程式为____;向盛有滤渣1的反应器中加入稀硫酸和过氧化氢溶液,应先加____,若顺序相反,会造成____。
(4)步骤②、④中,获得晶体的实验操作方法是____,过滤。
Ⅱ.另一同学也以该废催化剂为原料,采用下列实验操作方法也得到了ZnSO4。
![]()
(5)若一次水解时,产物为Zn( OH)xCly。取一次水解产物10. 64 g,经二次水解、干燥,得到9.9 g的Zn(OH)2(假设各步均转化完全),则一次水解产物的化学式为_______ .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在25℃,101kPa下,lg C8H18(辛烷)(相对分子质量:114)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是( )
A. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ·mol-1
B. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1
C. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1
D. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。下列叙述正确的是( )
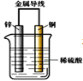
A. 该装置将化学能转变为电能
B. 电流从锌片流向铜片
C. 一段时间后,铜片质量减轻
D. 锌片发生还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】研究性学习小组的同学,为测定某含铜3%~5%的铝铜合金(不含其它元素)中铜的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
[方案一]将铝铜合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的化学方程式是___。
(2)称取5.4g铝铜合金粉末样品,溶于VmL2.0mol/LNaOH溶液中。为使其反应完全,则NaOH溶液的体积V≥___mL。过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得铜的质量分数将__(填“偏高”、“偏低”或“无影响”)。
[方案二]将铝铜合金与足量稀硫酸溶液反应,用量筒或者量气管测定生成气体在通常状况(约20℃,1.01×105Pa)的体积。
(3)同学们拟选用图1实验装置完成实验:实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因___。
(4)实验结束时 ,生成氢气的体积近似等于___。
(5)锥形瓶中残存的氢气对实验结果是否有影响___(填“有”“没有”或“不能判断”)
(6)同学们仔细分析图1实验装置后,经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了图2的实验装置。
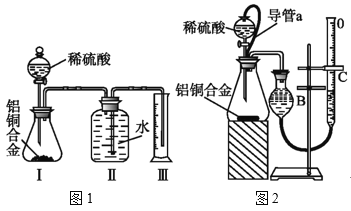
①装置中导管a的作用是___。
②实验中准确测定出实验前铝铜合金质量m1g,实验后铝铜合金质量m2g,产生的气体体积为(V2-V1)ml。利用上述数据计算通常状况下的气体摩尔体积:Vm=___。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线如下:
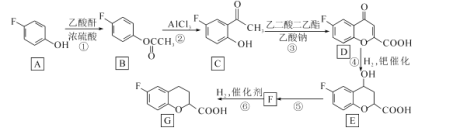
已知:乙酸酐的结构简式为![]() 。请回答下列问题:
。请回答下列问题:
(1)G中含氧官能团的名称是______________
(2)反应①的化学方程式为__________________
(3)反应⑤所需的试剂和条件是____,该反应类型是______________
(4)写出满足下列条件的C的同分异构体的结构简式________________________。
I.苯环上只有两种取代基;Ⅱ,核磁共振氢谱图中只有4组吸收峰;Ⅲ.能与NaHCO3溶液反应生成CO2。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。则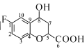 中的手性碳是____(填碳原子的数字标号)。
中的手性碳是____(填碳原子的数字标号)。
(6)设计以![]() 为原料制备
为原料制备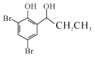 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。
_____________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com