
科目: 来源: 题型:
【题目】室温下,0.1 mol/L 的某二元酸 H2A 溶液中,可能存在的所有含 A 粒子的物质的量分数随 pH 变化的关系如图所示。下列说法不正确的是

A.H2A 的电离方程式:H2A=H+ + HA-
B.NaHA 溶液显酸性
C.等物质的量浓度的 NaHA 和Na2A 溶液等体积混合,离子浓度大小关系为:c(Na+)>c(A2-)>c(HA-)
D.pH = 5 时,在NaHA 和 Na2A 的混合溶液中: c(HA-) : c(A2-)= 100:1
查看答案和解析>>
科目: 来源: 题型:
【题目】计算题:(必需写出计算过程)
(1)在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.0080mol/L
①求该反应的平衡常数。_____
②在上述温度下,该容器中若通入H2和I2蒸气各0.20mol,试求达到化学平衡状态时各物质的浓度。____
(2)利用N2H4(肼)在NO2中燃烧,生成N2、液态H2O,是火箭发射常用的反应之一。已知:N2(g)+2O2(g)=2NO2(g) △H1=+67.2kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(l) △H2=-534kJ/mol,假如都在相同状态下,请写出发射火箭反应的热化学方程式。(需写出过程)____
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应2SO2(g) + O2(g)![]() 2SO3(g) △H<0
2SO3(g) △H<0
①增加O2的浓度,平衡___移动,SO2的浓度___,SO3的物质的量___。
②增大压强,平衡___移动, SO2的浓度____,SO3的浓度___。
③升高温度,平衡____移动,SO2的浓度___,SO3的浓度____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:回答下列问题:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:回答下列问题:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(选填吸热、放热)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为___℃。此温度下加入2molCO2(g)和2molH2(g),充分反应,达到平衡时,H2的转化率为___。
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为:CO2(g)为2 mol/L,H2(g)为2mol/L,CO(g)为1mol/L,H2O(g)为3mol/L,则正、逆反应速率的关系为v(正)___v(逆)(填<、>、或=)
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是
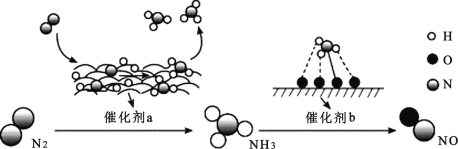
A.催化剂 a 表面发生了共价键的断裂和形成,但分子总数不变
B.在催化剂b 表面形成新的共价键时,存在微粒间的电子转移
C.N2 与H2 反应生成 NH3 的原子利用率不足 100%
D.催化剂 a、b 能提高反应的平衡转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2H2S(g)+O2(g) = S2(s)+2H2O(l) △H= -632 kJmol-1,如图为质子膜H2S 燃料电池的示意图。下列说法正确的是

A.标准状况下,每 11.2 LH2S 参与反应,有1 mol H+经固体电解质膜进入正极区
B.电池工作时,电子从电极b 经过质子膜流向电极 a
C.电路中每流过 4 mol 电子,电池内部释放632 kJ 的热能
D.电极b 上发生的电极反应式为:O2+4e-+2H2O = 4OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4 和极少量的PbO2)和稀H2SO4 为原料制备高纯PbO 的工艺流程如下:
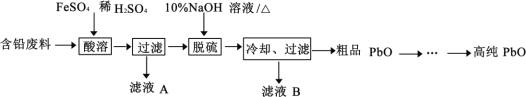
(1)铅蓄电池放电时负极的电极反应________。
(2)酸溶过程中含铅废料需要粉碎,其目的是__________,在 Fe2+催化下,PbO2 和Pb 反应生成PbSO4,生成 1molPbSO4 转移电子的物质的量__________mol。
(3)滤液A 中含有的主要阳离子是______(填离子符号)。
(4)脱硫过程发生的主要反应的离子方程式为______。
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,检验沉淀是否洗涤干净的方法是______
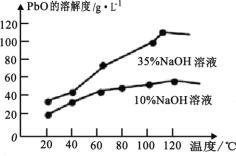
(6)PbO 溶解在NaOH 溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq) 。 PbO 的溶解度曲线如图所示。结合该曲线,简述由粗品PbO 得到高纯PbO 的操作:将粗PbO 溶解在一定量______(填“35%”或“ 10%)NaOH 溶液中,加热至 110℃左右,充分溶解后,_______,将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO。
NaHPbO2(aq) 。 PbO 的溶解度曲线如图所示。结合该曲线,简述由粗品PbO 得到高纯PbO 的操作:将粗PbO 溶解在一定量______(填“35%”或“ 10%)NaOH 溶液中,加热至 110℃左右,充分溶解后,_______,将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)若反应2NO(g)+O2(g)![]() 2NO2的平衡常数为K1,2NO2(g)
2NO2的平衡常数为K1,2NO2(g)![]() N2O4(g)的平衡常数为K2,则反应2NO(g)+O2(g)
N2O4(g)的平衡常数为K2,则反应2NO(g)+O2(g)![]() N2O4(g)的平衡常数K=___。
N2O4(g)的平衡常数K=___。
(2)25℃、101KPa时,1Kg乙醇充分燃烧后放出的热量为29714kJ,则乙醇的燃烧热△H=__。
(3)反应mA+nB![]() pC在某温度下达到平衡。
pC在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关是___。
②若C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向___方向移动。
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为__态。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验小组为探究SO2、Cl2的性质,并比较SO2和氯水的漂白性,设计了如下的实验。
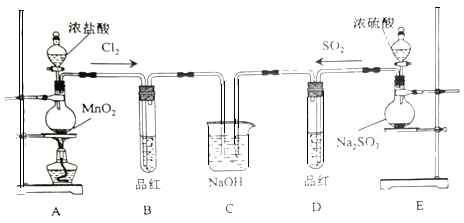
(1)图中盛放浓盐酸仪器的名称为___,装置A中发生反应的化学方程式___。
(2)反应一段时间后,B、D中品红褪色。反应结束后,分别加热B、D中的试管,可观察到的现象为:B___、D___。
(3)C装置的作用是吸收尾气,写出SO2与足量NaOH溶液反应的离子方程式:___。
(4)有同学将SO2和Cl2按1:1同时通入到品红溶液中,发现褪色效果并不明显。可能的原因是___(用化学方程式表示),设计实验证明上述原因___。
查看答案和解析>>
科目: 来源: 题型:
【题目】镍的全球消费量仅次于铜、铝、铅、锌,居有色金属第五位,常用于各种高光泽装饰漆和塑料生产,也用作催化剂,制取原理:Ni(CO)4(g)![]() Ni(s)+4CO(g),实验室用如图所示装置制取Ni(CO)4。
Ni(s)+4CO(g),实验室用如图所示装置制取Ni(CO)4。
已知:CO+PdCl2+H2O=CO2+Pd↓(黑色)+2HCl;Ni(CO)4熔点-25℃,沸点43℃,60℃以上与空气混合易爆炸;Fe(CO)5熔点-20℃,沸点103℃。

回答下列问题:
(1)装置A中发生反应的化学方程式为__。
(2)装置C用于合成Ni(CO)4夹持装置略,最适宜选用的装置为__(填标号)。

(3)实验过程中为了防止__,必须先观察__。
(4)制得的Ni(CO)4中常溶有Fe(CO)5等杂质,提纯的方法是__(填标号)。
A.分液 B.蒸馏 C.过滤 D.重结晶
(5)利用“封管实验”原理可获得高纯镍。如图所示的石英玻璃封管中充有CO气体,则高纯镍粉在封管的__温度区域端生成(填“323K”或“473K”)。

(6)实验中加入11.50gHCOOH,C装置质量减轻2.95g设杂质不参加反应 ,E装置中盛有PdCl2溶液100mL,则PdCl2溶液的物质的量浓度至少为__molL-1(填实验现象再加热C装置)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com