
科目: 来源: 题型:
【题目】高纯镍常用作加成反应的催化剂,制取原理:Ni(s)+4CO(g)![]() Ni(CO)4(g),实验室用如图所示装置制取Ni(CO)4,已知CO+PdCl2+H2O=CO2+Pd↓(黑色)+2HCl;Ni(CO)4熔点-25℃,沸点43℃,60℃以上与空气混合易爆炸:Fc(CO)5熔点-20℃,沸点103℃。回答下列问题:
Ni(CO)4(g),实验室用如图所示装置制取Ni(CO)4,已知CO+PdCl2+H2O=CO2+Pd↓(黑色)+2HCl;Ni(CO)4熔点-25℃,沸点43℃,60℃以上与空气混合易爆炸:Fc(CO)5熔点-20℃,沸点103℃。回答下列问题:
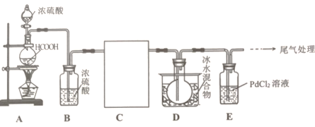
(1)装置A中发生反应的化学方程式为__________________。
(2)装置C用于合成Ni(CO)4(夹持装置略),最适宜选用的装置为__________________(填标号).
(3)实验过程中,必须先观察到__________________(填实验现象)才加热C装置,原因是__________________。
(4)制得的Ni(CO)4中常溶有Fe(CO)5等杂质,提纯的方法是__________________(填标号).
A.分液 B.过滤 C.蒸馏 D.蒸发浓缩、冷却结晶
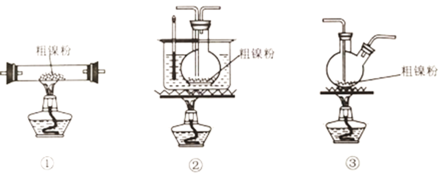
(5)利用“封管实验“原理也可冶炼高纯镍。如图所示的石英玻璃封管中充有CO气体,则不纯的镍(Ni)粉应放置在封管的__________________温度区域端(填“323K”、“473K”)

(6)实验中加入6.90gHCOOH,C装置质量减轻1.18g(设杂质不参加反应,)E装置中盛有PdCl2溶液200mL.则PdCl2溶液的物质的量浓度至少为__________________molL-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线:
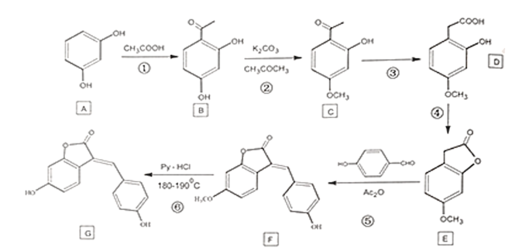
回答下列问题:
(1)A的化学名称为_________________。
(2)B中含有的官能团名称为_________________。
(3)下列有关G的说法中正确的是_________________。
A.常温下易溶于水
B.分子式为C15H9O4
C.可使酸性KMnO4溶液褪色
D.与NaOH反应时,lmolG最多消耗4mo1NaOH
(4)写出E到F的化学反应方程式_________________。
(5)⑥的反应类型为_________________。
(6)写出符合以下条件的D的同分异构体的结构简式_________________。
①能与NaHCO3溶液反应:
②能使FeCl3溶液变紫色:
③核磁共振氢谱峰面积比为1:1:2:6。
(7)设计由![]() 和
和![]() 为起始原料制备
为起始原料制备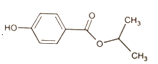 的合成路线(其他试剂任选)。_________________
的合成路线(其他试剂任选)。_________________
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL 2 mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。图中横坐标表示加入NaOH溶液的体积,纵坐标表示生成沉淀的质量,有关说法正确的是( )
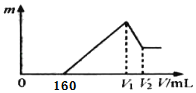
A.V1=400
B.金属粉末中含铝1.35 g
C.最后剩余沉淀质量5.8 g
D.无法确定V2的数值
查看答案和解析>>
科目: 来源: 题型:
【题目】下列能用勒夏特列原理解释的是( )
A. 经粉碎的硫黄燃烧得较快、较完全
B. 实验室可以用饱和食盐水收集氯气
C. 合成NH3反应为放热反应,为提高NH3的产率,应采取升高温度的措施
D. 对H2、I2、HI平衡体系加压混和气体后颜色变深
查看答案和解析>>
科目: 来源: 题型:
【题目】100 mL 0.5 mol/L碳酸钠溶液和100 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则关于盐酸的浓度可能是( )
A.0.25 mol/LB.0.5 mol/LC.0.75 mol/LD.1 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】为确定HCl、H2CO3、H2SiO3的酸性强弱,某同学设计了如图所示的装置,下列有关叙述正确的是( )
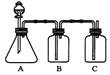
A.HCl、H2CO3、H2SiO3的酸性依次增强
B.A中锥形瓶中生成CO2气体
C.B中装饱和Na2CO3溶液,用于除去A中挥发出的HCl气体
D.C中装Na2SiO3溶液,预期现象是先出现白色沉淀后又逐渐溶解
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖颁发给三位开发锂离子电池的科学家。锂离子电池正极材料是决定其性能的关键.
(1)锰酸锂(LiMn2O4)电池具有原料成本低、合成工艺简单等优点。Li+能量最低的激发态离子的电子排布图为________,该晶体结构中含有Mn4+,基态Mn4+核外价层电子占据的轨道数为__________________个。
(2)磷酸铁锂(LiFePO4)电池安全、充电快、使用寿命长,其中P原子的杂化方式为__________________,阴离子的空间结构为__________________。
(3)三元正极材料![]() 掺杂Al3+可使其性能更优,第四电离能:Mn__________________Al(填“大于”“小于”),原因是__________________。
掺杂Al3+可使其性能更优,第四电离能:Mn__________________Al(填“大于”“小于”),原因是__________________。
(4)铋化锂被认为是很有潜力的正极材料,晶胞结构如图所示。

①晶胞可以看作是由铋原子构成的面心立方晶格,锂原子填充在其中的四面体和八面体空隙处。晶体的化学式为__________________,图中铋原子坐标参数:A为(0,0,0), B为(0,1,1),C为__________________。
②若晶胞参数为anm,则铋原子的半径为__________________nm,八面体间隙中的锂原子与四面体间隙中的锂原子之间的最短距离为__________________nm。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁是人类应用较早,当前应用量最大的金属元素。下列有关说法中正确的是( )
A.人类使用铁制品在铝之后
B.常温下,铁不能与浓硝酸反应
C.铁与水蒸气在高温下的反应产物为Fe2O3和H2
D.除去FeCl3溶液中的FeCl2杂质可以向溶液中加入适量氯水
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取、储存一直是氢能源利用领域的研究热点。
(1)工业上制取![]() 有多种方法,如:
有多种方法,如:
①![]()
②![]()
③![]()
甲烷和水蒸气催化重整制高纯氢时,初始反应的生成物为![]() 和
和![]() ,其物质的量之比为4:1,则该反应的热化学方程式为________。
,其物质的量之比为4:1,则该反应的热化学方程式为________。
(2)镧镍合金是一种良好的储氢材料,向体积恒定的密闭容器中充入氢气发生如下反应:![]() 。
。![]() 的平衡转化率与其初始充入物质的量
的平衡转化率与其初始充入物质的量![]() 、反应温度
、反应温度![]() 的关系如左图所示;一定温度下,容器内的压强
的关系如左图所示;一定温度下,容器内的压强![]() 随时间
随时间![]() 的变化关系如右图所示。
的变化关系如右图所示。
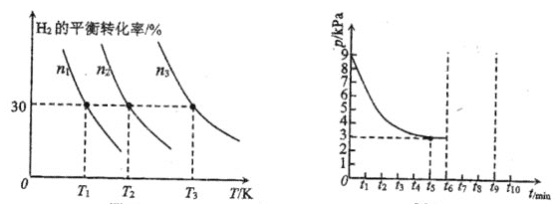
①左图中![]() 初始充入量由大到小的是________。
初始充入量由大到小的是________。
②该反应平衡常数的大小关系为![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ,理由是________。
,理由是________。
③若保持温度不变,在![]() 时刻将容器的容积压缩至原来的一半,并在
时刻将容器的容积压缩至原来的一半,并在![]() 时刻达到平衡。请在右图中画出相应的变化曲线______。
时刻达到平衡。请在右图中画出相应的变化曲线______。
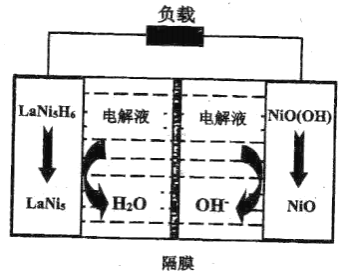
④某二次镍氢电池放电时的工作原理如图所示,其中隔膜为________离子交换膜![]() 填“阴”或“阳”
填“阴”或“阳”![]() ,负极的电极反应式为________。
,负极的电极反应式为________。
(3)储氢还可以借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
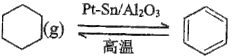
![]() 。在某温度下,向容积为2L的恒容容器中加入
。在某温度下,向容积为2L的恒容容器中加入![]() 环己烷,平衡时体系中压强为
环己烷,平衡时体系中压强为![]() ,苯的物质的量为
,苯的物质的量为![]() ,则平衡常数
,则平衡常数![]() ________
________![]() 用含a、b、p的代数式表示;用平衡分压代替平衡浓度计算,分压
用含a、b、p的代数式表示;用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Cr(OH)3是类似Al(OH)3的两性氢氧化物,Ksp[Al(OH)3]=1.3×10-33,Ksp[Cr(OH)3]=6.3×10-31。如图为Cr和Al两种元素在水溶液中存在的形式与pH的关系,图中纵轴表示lgc(M3+)或lgc[M(OH)4-](其中M=Al或Cr)。下列说法错误的是( )
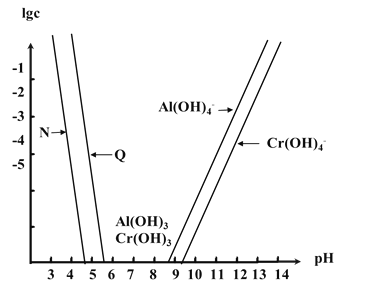
A.曲线N表示Al3+的浓度变化
B.在Al(OH)3和Cr(OH)3混合悬浊液中滴加NaOH溶液,Al(OH)3先溶解
C.在Al(OH)3和Cr(OH)3共沉淀的体系中![]() ≈4.8×102
≈4.8×102
D.若溶液中Al3+和Cr3+起始浓度均为0.1molL-1,通过调节pH能实现两种元素的分离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com