
科目: 来源: 题型:
【题目】在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如下图:
CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如下图:
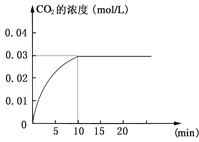
(1)根据上图数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)= mol/(L·min);反应达平衡时,c(H2)=____________mol/L,该温度下的平衡常数K= (计算出结果)。
(2)判断该反应达到平衡的依据是________________。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为零
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的 CO2和0.1 mol的H2,在相同的条件下,反应达平衡时,c(H2O)=_____________mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】铍作为一种新兴材料日益被重视,是原子能、火箭、导弹、航空以及冶金工业中不可缺少的宝贵材料。铍及其化合物大多具有毒性。如图是以一种已经预处理后的含铍矿绿柱石(主要含有![]() ,
,![]() ,
,![]() ,
,![]() 和
和![]() 等)为原料制取单质铍的工艺流程:
等)为原料制取单质铍的工艺流程:
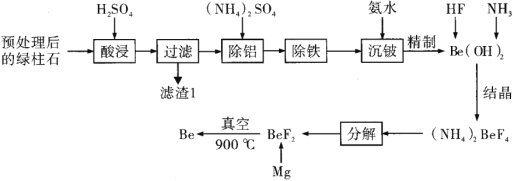
已知:i.铍和铝的化学性质相似;
ii.氯化铍在融熔态时较难电离;
iii.Be(OH)2在![]() 时会溶解;
时会溶解;
iV.![]() 。
。
(1)滤渣1的主要成分是________。
(2)在“除铝”过程中铝会以铝铵矾![]() 的形式析出,则此过程中生成铝铵矾的化学方程式为________。
的形式析出,则此过程中生成铝铵矾的化学方程式为________。
(3)“除铁”过程要求不引入新的杂质,其操作应为________。
(4)在“沉铍”过程中,若改为加入过量的![]() 溶液,则铍的存在形式是________(填离子符号)。
溶液,则铍的存在形式是________(填离子符号)。
(5)在“分解”过程中产生的![]() 烟气会发生反应:
烟气会发生反应:![]() ,可用
,可用![]() 代替
代替![]() 用于雕刻玻璃,反应过程中有
用于雕刻玻璃,反应过程中有![]() 生成,请写出此反应的化学方程式:________。
生成,请写出此反应的化学方程式:________。
(6)工艺中采用氟化铍镁热还原法制取铍需要真空环境的原因是________。氯化铍熔盐电解法也可以制取铍,但是在电解过程中需要加入等量的![]() ,加入
,加入![]() 的作用是________。
的作用是________。
(7)铍铜因具有良好的导电性、导热性、耐腐蚀性、耐热冲击性以及无磁性、无火花等特性而成为最为广泛使用的一种铍合金。若绿柱石中![]() 的含量为a%,上述工艺流程中
的含量为a%,上述工艺流程中![]() 的产率为b%,则1t绿柱石理论上可以生产含2%Be的铍铜合金________t。
的产率为b%,则1t绿柱石理论上可以生产含2%Be的铍铜合金________t。
(8)工艺流程中产生的含有![]() 的废水可以用石灰中和——生物净化法进行净化。不同的pH值和温度下,石灰中和——生物净化法净化后溶液中的铍的浓度如图所示,则为了减少污染,最应选用的pH范围和温度分别是________(填序号)。
的废水可以用石灰中和——生物净化法进行净化。不同的pH值和温度下,石灰中和——生物净化法净化后溶液中的铍的浓度如图所示,则为了减少污染,最应选用的pH范围和温度分别是________(填序号)。
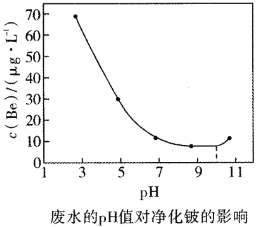
A.9~11,30℃ B.7~10,30℃ C.8~11,35℃
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐为沉淀。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。甲组、乙组两位同学对草酸分解产物进行探究。甲组同学认为:草酸分解产物中有CO2;乙组同学认为:草酸分解产物中还有CO。回答下列问题:
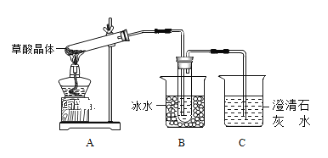
(1)甲组同学按照上图所示的装置连接,通过实验检验草酸晶体的分解产物。加热A装置前需要进行的操作是______________________;装置C中可观察到的现象是______________________________,装置C中发生的化学方程式_________________;由此可知草酸晶体分的产物中有___________(填化学式)。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验.
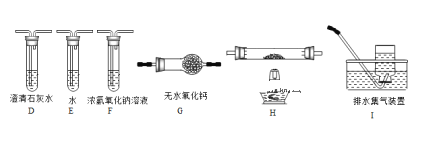
①乙组同学的实验装置中,依次连接的合理顺序为A、B、F、D、G____________(按合理顺序补全装置,填大写字母)。装置H反应管中盛有的物质是______________,此反应管中发生反应的化学方程式是_______________________。
②能证明草酸晶体分解产物中有CO的现象是_____________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某粗盐样品中含有Na2SO4、MgCl2、CaCl2等杂质.实验室提纯流程如下:
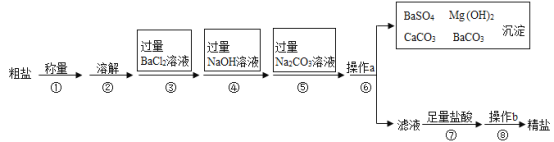
(1)用托盘天平称量粗盐时,若砝码和粗盐位置放颠倒,天平平衡时,读数为5.4g,实际称得粗盐的质量是__________。
A.5.4g B.4.6g C.6.0g D.5.0g
(2)第③步操作发生反应的化学方程式是__________________________
(3)第④步操作发生反应的化学方程式是_______________________
(4)第⑤步操作的目的是 ___________________________
(5)第⑥步操作a的名称是 ________,此步操作中,玻璃棒的末端要轻轻地斜靠在 _____________的一边。
(6)第⑦步操作中,向滤液中滴加足量盐酸的目的是_____________,此步操作中产生气泡的化学方程式是___________________。
(7)在第⑧步操作时,要用玻璃棒不断搅拌,目的是_______________________
查看答案和解析>>
科目: 来源: 题型:
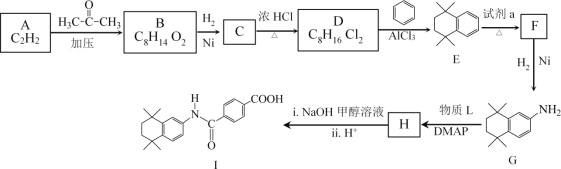
【题目】他米巴罗汀(I)可用于治疗急性白血病,其合成研究具有重要意义,合成路线如图所示。
已知:i.HC![]() CH+
CH+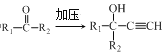
ii.R—NO2![]() R—NH2
R—NH2
iii.R1—NH2+![]() +HCl
+HCl
(1)A中官能团名称是_________。
(2)B的结构简式是________。
(3)D→E的化学方程式是__________。
(4)试剂a是_________。
(5)已知H在合成I的同时,还生成甲醇,G→H所加物质L的结构简式是______。
(6)B的一种同分异构体符合下列条件,其结构简式是________。
①能发生银镜反应
②核磁共振氢谱只有两组吸收峰
(7)D→E的过程中有多种副产物,其中属于高分子化合物的结构简式是_______。
(8)![]() 也是合成他米巴罗汀(I)的一种原料,合成路线如图所示。利用题中所给信息,中间产物的结构简式是_______________。
也是合成他米巴罗汀(I)的一种原料,合成路线如图所示。利用题中所给信息,中间产物的结构简式是_______________。

查看答案和解析>>
科目: 来源: 题型:
【题目】容积固定的密闭容器中,发生可逆反应:M(g)+N(g)![]() 2P(g)+Q(g) ΔH>0,
2P(g)+Q(g) ΔH>0,
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N 的浓度是________,P 的体积分数为_________。
(2)若反应温度升高,M的转化率____________ (填“增大”“减小”或“不变”,下同),平均相对分子质量____________,混合气体密度____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验小组制备NaNO2,并探究其性质。
I.制备NaNO2
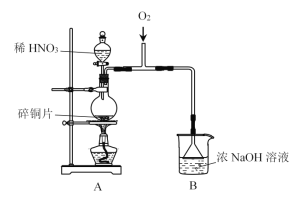
(1)A中发生反应的化学方程式是__________。
(2)B中选用漏斗替代长直导管的优点是________。
(3)为检验B中制得NaNO2,甲进行以下实验:
序号 | 试管 | 操作 | 现象 |
① | 2 mLB中溶液 | 加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 | 不变蓝 |
② | 2 mLB中溶液 | 滴加几滴H2SO4至pH=5,加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 | 变蓝 |
③ | 2 mLH2O | 滴加几滴H2SO4至pH=5,加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 | 不变蓝 |
实验③的目的是________。
(4)乙认为上述3组实验无法证明B中一定含NaNO2,还需补充实验,理由是_________。
II.探究NaNO2的性质
装置 | 操作 | 现象 |
| 取10 mL1 mol/LNaNO2溶液于试剂瓶中,加入几滴H2SO4酸化,再加入10 mL1 mol/LFeSO4溶液,迅速塞上橡胶塞,缓缓通入足量O2。 | i.溶液迅速变为棕色; ii.溶液逐渐变浅,有无色气泡产生,溶液上方为浅红棕色。 iii.最终形成棕褐色溶液。 |
资料:i.[Fe(NO)]2+在溶液中呈棕色。
ii.HNO2在溶液中不稳定,易分解产生NO和NO2气体。
(5)溶液迅速变为棕色的原因是_________。
(6)已知棕色溶液变浅是由于生成了Fe3+,反应的离子方程式是_________。
(7)最终棕褐色溶液的成分是Fe(OH)x(SO4)y,测得装置中混合溶液体积为20 mL,设计如下实验测定其组成。
资料:充分反应后,Fe2+全部转化为Fe(OH)x(SO4)y。
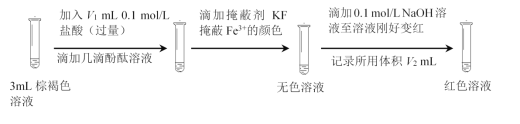
Fe(OH)x(SO4)y中x=_______(用含V1、V2的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】石油炼制过程中产生的H2S是一种有毒气体,其有效利用是亟需解决的问题。
(1)H2S的电子式是_________。
(2)热分解法处理H2S
H2S(g)=H2(g)+S(s) ΔH1
已知:i.2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH2
ii.S(s)+O2(g)=SO2(g) ΔH3
①利用ΔH2和ΔH3计算ΔH1时,还需要利用_______反应的ΔH。
②直接加热分解H2S转化率低,科学家发现MoS2可以催化H2S分解制取氢气和硫磺,多孔陶瓷膜可以使氢气选择性分离。科学家使用沉积有MoS2的多孔陶瓷膜装置进行反应的原因有_________。
(3)电化学法处理H2S
为避免硫磺沉积在阳极,将氧化吸收和电解制氢过程分开进行,装置如图所示。氧化吸收器中为Fe2(SO4)3溶液,电解反应器中,以石墨为阳极,以Pt为阴极,中间用质子交换膜隔开。
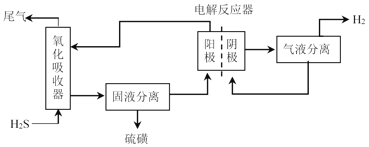
①氧化吸收器中反应的离子方程式为_________。
②电解反应器中,阴极的电极反应式为_________。
③电解反应器的作用是_________(写出2点)。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国平原地区地下水质量差,铁、锰含量较高,需进行处理才能达到饮用水标准。地下水中铁锰的来源主要是矿物FeCO3和MnCO3。
(1)酸雨地区地下水中铁含量更高,结合化学用语从平衡移动角度解释原因_______。
(2)去除Fe2+
①除铁滤池经过曝气3~7天后,滤料表面形成______色物质,其成分是Fe(OH)3,使得溶液中Fe2+含量迅速下降,其作用过程如图所示。
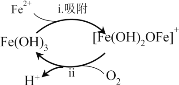
②将过程ii的离子方程式补充完整:________。
过程i:Fe2++Fe(OH)3=[Fe(OH)2OFe]++H+
过程ii:4[Fe(OH)2OFe]++ +10H2O= +
③有利于提高过程ii反应速率的措施是______(填序号)。
A. 降低温度 B. 通入足量O2 C. 搅拌
(3)去除Mn2+
向除锰滤池中加入ClO2将Mn2+氧化为MnO2,随着反应进行,滤池溶液的pH___(填“变大”“变小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com