
科目: 来源: 题型:
【题目】麻黄素(H)是中枢神经兴奋剂,其合成路线如图所示。NBS是一种选择性溴代试剂。

已知:CH3—C≡CH+H2O![]() CH3COCH3
CH3COCH3
(1)A的结构简式是_______;E中官能团的名称为___________________。
(2)反应B→C的反应条件和试剂是_______________,⑤的反应类型是________。
(3)F的结构简式是______________。麻黄素(H) 的分子式是________。
(4)写出C→D的化学方程式______________________________________。
(5)化合物F的芳香族同分异构体有多种,结构和性质如下:遇FeCl3溶液发生显色反应,能和银氨溶液发生银镜反应,苯环上只有两个对位取代基,则符合上述要求的同分异构体结构简式可能为________________________________________。
(6)请仿照题中合成流程图,设计以乙醇为起始主原料合成强吸水性树脂![]() 的合成路线______________(用流程图表示,其它试剂及溶剂任选)。
的合成路线______________(用流程图表示,其它试剂及溶剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】K、Al、Cu、H、C、O、S、Cl是常见的八种元素。
(1)从明矾[KAl(SO4)2·12H2O]制备 Al、K2SO4和H2SO4的过程如下图所示:
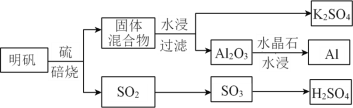
焙烧明矾的化学方程式为_________________________________________________。
(2)K位于元素周期表第________周期第________族。
(3)S的基态原子核外有________个未成对电子;Cl的基态原子核外电子排布式为____________。
(4)用“>”或“<”填空:
第一电离能 | 离子半径 | 熔点 | 酸性 |
O____S | Cl-____K+ | KCl____Al2O3 | H2SO4____HClO4 |
(5)SO2的价层电子对个数是________,该分子为结构为________;SO3中硫原子采用杂化方式为___________。
(6)新制备的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙酸的沸点明显高于乙醛,其主要原因是____________________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________个铜原子。
(7)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,列式表示Al单质的密度__________g·cm-3(列出计算式子,不必计算出结果)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体 ,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现红色。
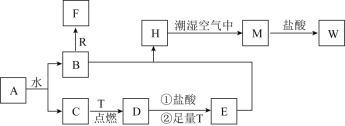
(1)物质D的化学式为___________,H的名称___________。
(2)![]() 在潮湿空气中变成M的实验现象是______________,化学方程式为___________。
在潮湿空气中变成M的实验现象是______________,化学方程式为___________。
(3)![]() 与W溶液也能发生反应,其反应的类型为______(填序号)。
与W溶液也能发生反应,其反应的类型为______(填序号)。
![]() 化合反应
化合反应 ![]() 置换反应
置换反应 ![]() 复分解反应
复分解反应 ![]() 氧化还原反应
氧化还原反应
(4)![]() 和R在溶液中反应生成F的离子方程式为____________________。
和R在溶液中反应生成F的离子方程式为____________________。
(5)将![]() 投入到E溶液中,可以观察到的现象是:___________________。
投入到E溶液中,可以观察到的现象是:___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列描述违背化学原理的是
A.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
B.反应A(g)+3B(g)![]() 2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大
2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大
C.SO2的催化氧化是一个放热的反应,升高温度,反应速率加快
D.多元弱酸各步电离常数相互关系为K1![]() K2
K2![]() K3
K3
查看答案和解析>>
科目: 来源: 题型:
【题目】将![]() 锌粒投入500mL 2mol/L的硫酸溶液中,试计算:
锌粒投入500mL 2mol/L的硫酸溶液中,试计算:
(1)产生的氢气在标准状况下的体积是__________;
(2)忽略溶液体积变化体积,反应后溶液中氢离子浓度是__________;
(3)要配制500mL 2mol/L的硫酸溶液,需用质量百分数为98%,密度为1.84g/cm3浓硫酸_______![]() 保留三位有效数字
保留三位有效数字![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积可变的密闭容器中充入2 mol A和1 mol B发生反应:mA(g) + nB(g) ![]() pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
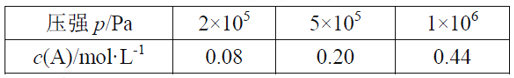
A. 维持压强2×105Pa,若反应开始后5min时达到平衡,则v(A)=0.016mol/(L·min)
B. P从2×105Pa增加到5×105Pa时,平衡逆向移动
C. P为1×106Pa时,平衡常数表达式K=![]()
D. 其它条件相同时,在上述三个压强下分别发生该反应。A的转化率随时间变化曲线如图所示
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用不同浓度的NaOH溶液分别滴定20 mL与其同浓度的某弱酸HA(电离常数为Ka)溶液,滴定曲线如下图所示。下列说法不正确的是( )。
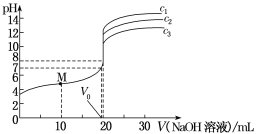
A.由图可知,c1>c2>c3
B.M点溶液中存在:c(H+)=![]() [c(A-)-c(HA)]+c(OH-)
[c(A-)-c(HA)]+c(OH-)
C.恰好中和时,三种溶液的pH相等
D.由pH=7的溶液计算得:Ka=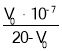 (V0是消耗的NaOH溶液的体积)
(V0是消耗的NaOH溶液的体积)
查看答案和解析>>
科目: 来源: 题型:
【题目】无水氯化铁加热易升华,遇潮湿空气易变质。在实验室中,可以采用如下装置和药品制取较纯的无水氯化铁固体。
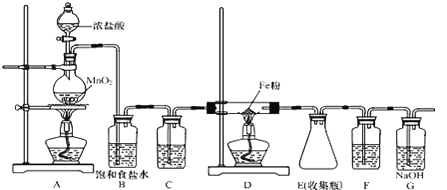
(1)制取氯化铁时,应先点燃_____(填“A”或“D”)处的酒精灯,制取氯化铁的化学方程式为_____。
(2)C、F装置中所装试剂相同,试剂均为________。
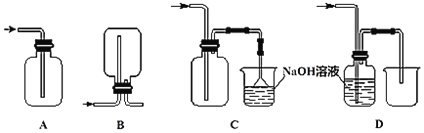
(3)下列收集Cl2的正确装置是______。
(4)G装置中反应的离子方程式为________________________________。
(5)反应后装置D中残余的固体混合物溶于稀盐酸,滴加几滴KSCN溶液。若溶液变血红色,推断固体物质的成分为______(选填序号,下同);写出溶液变血红色的离子方程式:_____________,若溶液未变血红色,推断固体物质的成分为______。
A.只有 FeCl3 B.只有Fe C.一定有FeCl3 D.一定有Fe
查看答案和解析>>
科目: 来源: 题型:
【题目】一种新型的锌碘单液流电池,其原理如下图所示。下列说法不正确的是 ( )。
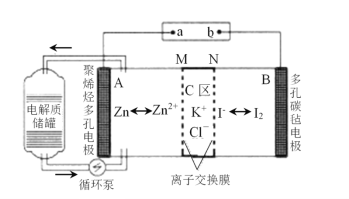
A.放电时B电极反应式为:I2+2e-=2I-
B.M为阳离子交换膜,N为阴离子交换膜
C.充电时,A极增重65g时,C区增加离子数为4NA
D.放电时电解质储罐中离子总浓度增大
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
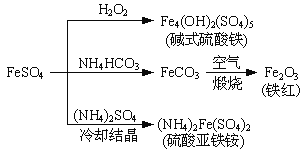
A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com