
科目: 来源: 题型:
【题目】为研究铜与浓硫酸的反应,实验小组同学进行如图实验,下列说法错误的是
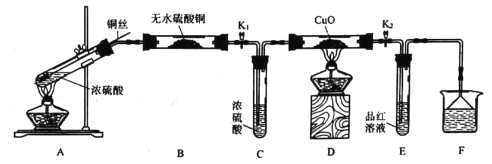
A.F中可以盛放酸性KMnO4溶液
B.为确认有硫酸铜生成,可向反应后的A中加水
C.此实验设计不能排除浓硫酸中的水是否影响B装置现象的判断
D.可通过D中固体不变色而E中溶液褪色的现象证明浓硫酸中硫元素的氧化性强于氢元素
查看答案和解析>>
科目: 来源: 题型:
【题目】以下是元素周期表中前18号某种金属元素对应的单质及其化合物之间的转化关系(“→”所指的转化都是一步完成)。
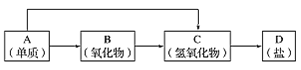
(1)若B为呼吸面具中的供氧剂,其供氧时每生成1molO2,反应过程中转移的电子数为_____,A与FeCl3溶液反应的离子方程式________________________。
(2)写出一个“C→D”转化的化学方程式_________________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃时,在恒容密闭容器中充入一定量的H2和CO,在催化剂作用下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)△H<0。反应达到平衡时,CH3OH体积分数与
CH3OH(g)△H<0。反应达到平衡时,CH3OH体积分数与![]() 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

A. 反应达平衡时,升高体系温度,CO转化率升高
B. 反应达平衡时,再充入一定量Ar,平衡右移,平衡常数不变
C. 容器内混合气体的密度不再变化说明该反应达到平衡状态
D. ![]() =2.5时达到平衡状态,CH3OH的体积分数可能是图中的F点
=2.5时达到平衡状态,CH3OH的体积分数可能是图中的F点
查看答案和解析>>
科目: 来源: 题型:
【题目】在2 L恒容密闭容器中充入![]() 、
、![]() ,在一定条件下发生如下反应:
,在一定条件下发生如下反应:![]()
![]() ;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是( )
;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是( )
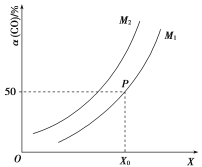
A.工业上,利用上述反应合成甲醇,温度越高越好
B.图象中X代表温度,![]()
C.图象中P点代表的平衡常数K为![]()
D.温度和容积不变,再充入![]() 、1 mol CO,达到平衡时CO的转化率减小
、1 mol CO,达到平衡时CO的转化率减小
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为短周期元素,表中所列序号分别代表一种元素。(除说明外都用化学用语填空)
① | ② | |||||||
③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
(1)上述元素中金属性最强和非金属性最强的元素名称分别是______,_______;
(2)①和②的气态氢化物稳定性比较(写化学式):______________;
(3)在上述元素中其最高价氧化物对应水化物酸性最强的酸为_________;写出⑤单质与③的最高价氧化物对应水化物反应的化学方程式为____________ 。描述H2在⑧单质中燃烧的现象___________________;
(4)现有上表中某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,该元素在周期表中的位置是_________________;
(5)比较②和③对应简单离子的离子半径大小(用相应离子符号表示)________;
(6)写出③的最高价氧化物对应水化物的电子式___________;其含有的化学键类型是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求回答下列问题。
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧CO2
(1)写出Na2O2的电子式________,存在的化学键类型有________________。
(2)写出HClO电子式________________,写出CO2的结构式_______。
(3)含有共价键的离子化合物是_______(填序号)
(4)用电子式表示CaBr2的形成过程_________________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以次氯酸盐和铁盐为原料制备少量K2FeO4的操作步骤如下:
Ⅰ.制备NaClO强碱性饱和溶液:
①将20 mL NaOH溶液加入仪器b中,冷水浴冷却,通入Cl2,搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止(装置如下图所示)。

②将所得饱和NaClO倒入烧杯并置于冷水浴中,分几次加入20 g NaOH固体并不断搅拌,过滤,得NaClO强碱性饱和溶液。
(1)甲装置中a管的作用是_____________________________________________。
(2)写出甲装置中反应的化学方程式_____________________________________。
(3)石灰乳的作用是___________________________________________________。
(4)反应过程中用冷水浴冷却的原因是___________________________________。
Ⅱ.合成K2FeO4:
①称取5.05 g Fe(NO3)3·9H2O(相对分子质量为404)固体,在冷水浴中分批加入Ⅰ中所得滤液,并不断搅拌,反应1小时后溶液呈深紫红色(即Na2FeO4)。
②离心分离除去Na2FeO4水解得到的Fe(OH)3胶体,留上层清液(深紫红色)。
③向②的上层清液中缓慢加入KOH饱和溶液50.00mL,冰水浴保持5 min,过滤,得K2FeO4(相对分子质量为198)粗产品。
④将粗产品重结晶,并用异丙醇洗涤,低温烘干,得纯产品2.13 g。
(5)合成Na2FeO4的离子方程式为____________________________________。
(6)过程③加入饱和KOH溶液即可得到K2FeO4粗产品,原因是__________。
(7)用异丙醇洗涤的目的是__________________________________________。
(8)K2FeO4的产率为___________(保留至0.1%)。
查看答案和解析>>
科目: 来源: 题型:
【题目】节能和减排建设友好型社会的必然选择。回答下列问题:
(1)已知在一定温度下,①C(s)+CO2(g) ![]() 2CO(g) ΔH1=a kJ·mol-1 平衡常数K1;
2CO(g) ΔH1=a kJ·mol-1 平衡常数K1;
②CO(g)+H2O(g) ![]() H2(g)+CO2(g) ΔH2=b kJ·mol-1 平衡常数K2。
H2(g)+CO2(g) ΔH2=b kJ·mol-1 平衡常数K2。
某反应的平衡常数表达式K3= ![]() ,请写出此反应的热化学方程式______________,K1、K2、K3之间的关系是_____________。
,请写出此反应的热化学方程式______________,K1、K2、K3之间的关系是_____________。
(2)将原料气按n(CO2)∶n(H2)=1∶4置于密闭容器中发生CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)反应,测得H2O(g)的物质的量分数与温度的关系如下图所示:
CH4(g)+2H2O(g)反应,测得H2O(g)的物质的量分数与温度的关系如下图所示:
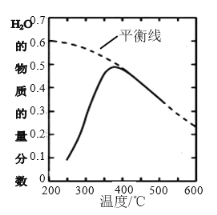
①该反应的平衡常数K随温度降低而________(填“增大”或“减小”)。
②在密闭恒温(高于100℃)恒容装置中进行该反应,达到平衡状态的是________。
a.混合气体密度不再改变 b.混合气体压强不再改变
c.混合气体平均摩尔质量不再改变 d.n(CO2)∶n(H2)=1:2
③200℃达到平衡时体系的总压强为P,该反应平衡常数Kp的计算表达式为______(不必化简,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)500℃时,CO与水反应生成CO2和H2,将其分离得到H2的过程示意图如下:

①阳极反应式是_______________________________________________。
②结合电极反应式,简述K2CO3溶液的再生原理___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业常用FeCl3溶液腐蚀附在绝缘板上的铜箔,制造印刷电路板。
(1)写出FeCl3溶液与金属铜反应的离子方程式____________________
(2)某小组采取下列步骤从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液。
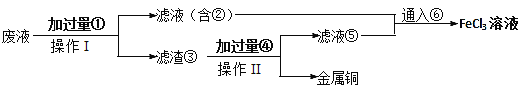
操作Ⅰ和Ⅱ的操作使用到的主要玻璃仪器有____,滤渣③含有的单质有______。通入气体⑥的化学式为______。
(3)若某腐蚀液中含1.5mol·L-1CuCl2、3.0mol·L-1FeCl2、1.0mol·L-1FeCl3,取200mL腐蚀液按上述步骤回收铜,为充分回收铜,加入①的质量最小为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com