
科目: 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)中提取氧化铝的两种工艺流程如图:
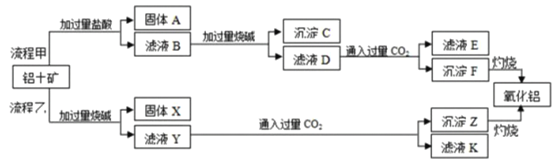
请回答下列问题:
(1)固体A的主要成分是___(写名称)。
(2)铝土矿与过量盐酸反应的离子方程式为___、___。
(3)电解熔融氧化铝可制得单质铝,写出该反应化学方程式____;已知氯化铝的熔点更低,工业中为何不用电解熔融氯化铝的方法制备该单质___。
(4)得到的单质铝可以跟强碱溶液放出氢气,每转移6.02×1025个电子,实际上参与反应的氧化剂为___mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.乙醛与新制氢氧化铜悬浊液加热反应:CH3CHO+2Cu(OH)2+OH-![]() CH3COO-+Cu2O↓+3H2O
CH3COO-+Cu2O↓+3H2O
B.向加碘食盐(含碘酸钾)中加入碘化钾溶液和稀硫酸:IO3-+I-+6H+=I2+3H2O
C.偏铝酸钠溶液中通入过量二氧化碳:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D.亚硫酸钠水解:SO32-+2H2O![]() H2SO3+2OH-
H2SO3+2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.35Cl和37Cl互为同位素
B.乙酸和油酸(C17H33COOH)互为同系物
C.红磷和白磷互为同素异形体
D.乙醛和环氧乙烷(![]() )互为同分异构体
)互为同分异构体
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究Na与C02反应产物,某化学兴趣小组按如图装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3

回答下列问题:
(1)写出A中反应的离子方程式_____________________________________;
(2)仪器X的名称是____________________,B中的溶液为_____________________;
(3)先称量硬质玻璃管的质量为mlg,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g.再进行下列实验操作,其正确顺序是____________(填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,通入C02至E中出现浑浊 e.称量硬质玻璃管 f.冷却到室温
重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
(4)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变黑,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是______________________________________;
(5)探究固体产物中元素Na的存在形式
假设一:只有Na2CO3;
假设二:只有Na2O;
假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
步骤 | 操作 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
m1 | m2 | m3 |
66.7g | 69.0g | 72.lg |
(6)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Na、Fe、Cl是中学化学常见的元素。回答下列问题:
(1)含上述元素的常见化合物中,呈淡黄色的是___(填化学式)。
(2)焰色反应的实验中,Na元素的焰色为___色,观察K元素的焰色需要透过___。
(3)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是___。
(4)MgO与碳粉和氯气在一定条件下反应可制备MgCl2,该反应的化学方程式为___。若尾气可用足量NaOH溶液完全吸收,则生成的盐为___(写化学式,只写一种)。
查看答案和解析>>
科目: 来源: 题型:
【题目】向100mlNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )
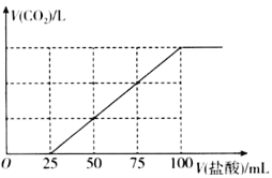
A.通入CO2后,所得溶液的溶质成分的物质的量之比为n(NaHCO3):n(Na2CO3)=1:1
B.通入CO2在标准状况下的体积为448mL
C.通入CO2后,所得溶液的溶质成分的物质的量之比为n(NaOH):n(Na2CO3)=1:3
D.原NaOH溶液的浓度为0.2mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
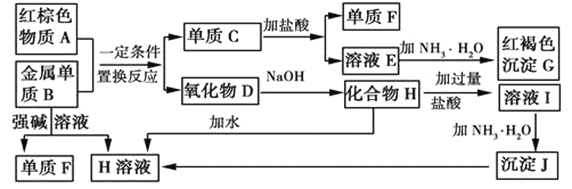
(1)单质F的化学式是___。
(2)写出由沉淀J生成 H溶液的离子方程式__。
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式:__,白色沉淀L最终变为红褐色沉淀G,写出L变为G的化学反应方程式__。
(4)溶液I中所含金属离子是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸是极其重要的化工原料,在工业、农业、医药、军事等领域应用广泛。工业上通常用接触法制硫酸,主要原料是硫铁矿和空气。接触法制硫酸的生产过程大致可分为三个阶段:二氧化硫的制取和净化;二氧化硫转化为三氧化硫;三氧化硫的吸收和硫酸的生成。为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为了测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
实验 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L(标准状况) |
1 | 7.24 | 50.00 | 1.792 |
2 | 14.48 | 50.00 | 3.584 |
3 | 21.72 | 50.00 | 4.032 |
4 | 36.20 | 50.00 | 2.240 |
(1)由1组数据直接推测:1.81g样品进行同样实验时,生成氨气的体积(标准状况)为___L。
(2)试计算该混合物中(NH4)2SO4和 NH4HSO4的物质的量之比为___。
(3)求所用NaOH溶液的物质的量浓度___mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究Na与C02反应产物,某化学兴趣小组按如图装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3

回答下列问题:
(1)写出A中反应的离子方程式_____________________________________;
(2)仪器X的名称是____________________,B中的溶液为_____________________;
(3)先称量硬质玻璃管的质量为mlg,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g.再进行下列实验操作,其正确顺序是____________(填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,通入C02至E中出现浑浊 e.称量硬质玻璃管 f.冷却到室温
重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
(4)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变黑,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是______________________________________;
(5)探究固体产物中元素Na的存在形式
假设一:只有Na2CO3;
假设二:只有Na2O;
假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
步骤 | 操作 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
m1 | m2 | m3 |
66.7g | 69.0g | 72.lg |
(6)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
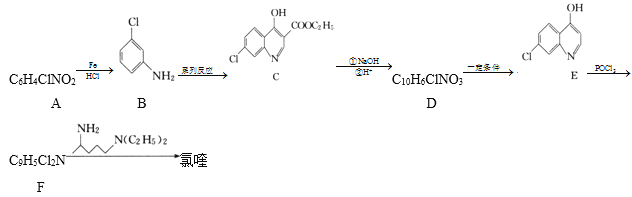
【题目】氯喹(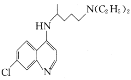 )可用于治疗新冠肺炎,氯喹的合成方法如图:
)可用于治疗新冠肺炎,氯喹的合成方法如图:
已知: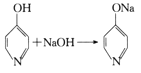 +H2O。
+H2O。
回答下列问题:
(1)A中所含官能团的名称是__,C的分子式为___。
(2)A生成B的反应类型为___,E生成F的反应类型为__。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。氯喹中的手性碳有__个。
(4)由C生成D的过程中,加入NaOH溶液时发生反应的化学方程式为___。
(5)X为E的同分异构体,写出一种满足如下条件的X的结构简式:___。
①遇FeCl3溶液发生显色反应
②除苯环外不含其他环,且苯环上只有2个取代基
③含有—CN
④核磁共振氢谱中只有4组峰,且峰面积之比为1:2:2:1
(6)设计以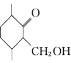 、CH3CH2CH2Br、CH3CH2ONa、CH3CH2OH为原料合成
、CH3CH2CH2Br、CH3CH2ONa、CH3CH2OH为原料合成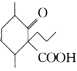 的合成路线___(无机试剂任选)。
的合成路线___(无机试剂任选)。
已知:R1CH2COOR2![]() R1CH(R3)COOR2
R1CH(R3)COOR2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com