
科目: 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
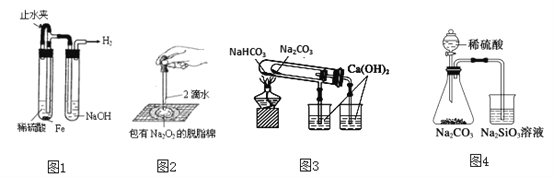
A. 图1:制备并观察氢氧化亚铁
B. 图2:证明过氧化钠与水反应放热
C. 图3:验证NaHCO3和Na2CO3的热稳定性
D. 图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是
A.氯气通入水中,溶液呈酸性:Cl2 + H2O ![]() 2H+ + Cl- + ClO-
2H+ + Cl- + ClO-
B.硅酸钠溶液与盐酸混合产生浑浊:SiO32-+2H+=H2SiO3↓
C.向FeBr2溶液中通入少量Cl2:Cl2 +2Br- = 2Cl-+ Br2
D.将磁性氧化铁溶于氢碘酸:Fe3O4+8H+=2Fe3++ Fe2++4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,等物质的量的N2和CO所含分子数均为NA
B.将含0.l mol FeCl3的饱和溶液制成胶体后,生成的Fe(OH)3胶粒数目为0.1NA
C.常温常压下,lmolNa 加热后生成的Na2O、Na2O2混合物中阴离子数目一定为0.5NA
D.1molFe与足量水蒸气在高温下充分反应后失电子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】在120℃时,某混合烃和过量O2在一密闭容器中完全反应,测知反应前后的压强没有变化,则该混合烃可能是
A.CH4和C2H4B.C2H2和C2H4C.C2H4和C2H6D.C3H4和C3H6
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇和乙酸是生活中常见的有机物,两者均可通过粮食酿造获得。
(1)乙醇和乙酸所含官能团的名称分别为______、______。
(2)可用于鉴别乙醇和乙酸的化学试剂是:______。(回答一种即可)
(3)写出乙醇与乙酸反应制取乙酸乙酯的化学方程式。______。
(4)工业上可用乙烯与水反应制取乙醇,该反应类型为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料
B.普通玻璃是以纯碱、石灰石和石英砂为原料制备的
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.粗硅制备单晶硅不涉及氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】锌锰干电池的负极材料是电池壳体的金属锌,正极是被二氧化锰和碳粉包围的石墨电极,电解质是氯化锌和氯化铵的糊状物,该电池放电过程中产生Mn2O3。利用废旧电池回收Zn、Mn化合物,对环境保护意义重大。
步骤一:向除去壳体及石墨电极的黑色糊状物中加水,搅拌,充分溶解,经过滤分离得到固体和滤液。
步骤二:处理固体,提取MnO2通过对获得的滤渣进行灼烧,灼烧的目的是__。灼烧时用到的实验仪器有酒精灯、玻璃棒、__。
步骤三:处理滤液,得到ZnCl2·xH2O晶体,再通过将SOCl2与ZnCl2·xH2O晶体混合可制取无水ZnCl2。有关的实验装置如图(夹持及加热装置略):
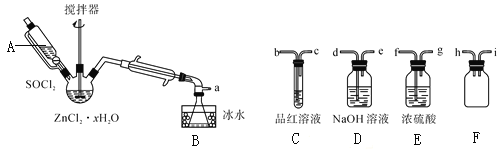
已知:SOCl2是一种常用的脱水剂,熔点-105℃,沸点79℃。140℃以上易分解,与水剧烈反应生成两种气体。
①仪器A的名称为__。
②蒸馏烧瓶中发生反应的化学方程式为:__。
③为回收剩余的SOCl2并验证生成物中含有SO2。上述仪器接目的连接响序为a→__。装置E中浓硫酸的作用___。
④为提高SOCl2的利用率,该实验宜采用的加热方式为__。
⑤讨论:将ZnCl2·xH2O晶体置于坩埚中加热均烧,__(能,不能)得到无水ZnCl2,原因是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要漂白剂,实验室可按下图装置制取NaClO2晶体。

已知:Ⅰ.A中发生的反应为:2ClO2+H2O2+2NaOH=2NaClO2+O2+2H2O
Ⅱ.NaClO2受热易分解,温度高于60℃时分解成NaClO3和NaCl。
(1)已知ClO2与Cl2类似具有漂白性,请设计检验ClO2漂白性的实验方案______。
(2)A中用冰水浴的目的是______。
(3)装置B的作用是______。
(4)测定样品中NaClO2的质量分数的实验过程如下:
步骤一:称0.5000 g样品,加入适量蒸馏水和过量的KI晶体和硫酸,发生如下反应:ClO![]() +4I﹣+4H+=2H2O+2I2+Cl﹣
+4I﹣+4H+=2H2O+2I2+Cl﹣
步骤二:将所得混合液稀释成100 mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液作指示剂,用0.2000 mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为15.00 mL(滴定过程中发生反应:I2+2S2O32-=2I﹣+S4O62-)。
①配制100 mL 0.2000 mol·L-1Na2S2O3标准溶液需要用到的玻璃仪器有烧杯、胶头滴管、______。
②请计算所称取样品中NaClO2的质量分数_______________。(写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其它化学试剂进行如下操作,得到了Fe2O3、Al2O3和金属Cu。
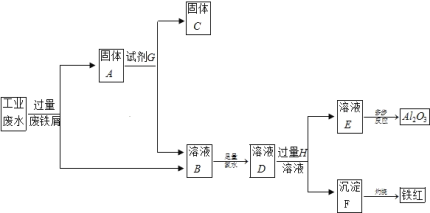
请回答:
(1)固体A的成分是____________(用化学式表示)。
(2)溶液B→沉淀F的现象是_______________,用化学方程式表示沉淀产生此现象的原理_______。
(3)写出下列反应的离子方程式:反应①中Fe3+发生的反应:_____________,D→E:__________。
(4)小明认为由溶液B→溶液D的过程并不符合绿色化学,所以将氯水换成了H2O2溶液,在该转化过程中若转移2mol 电子,则消耗质量分数为30%的H2O2溶液的质量为________g(精确到0.1g)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为__________________。必须用到的玻璃仪器有烧杯、胶头滴管、________________。
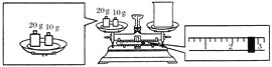
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为________ g,要完成本实验该同学应称出________ g NaOH。
(3)使用容量瓶前必须进行的一步操作是________。
(4)如图是该同学转移溶液的示意图,图中有两处错误,请写出:
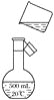
①________________________________________________________________________
②________________________________________________________________________
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________(填字母)。
A.所用NaOH已经潮解
B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里
D.用带游码的托盘天平称5.4 g NaOH(1 g以下用游码)时误用了“左码右物”方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com