
科目: 来源: 题型:
【题目】下图是以秸秆为原料制备某种聚酯高分子化合物的合成路线:
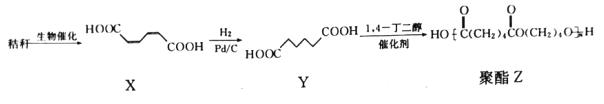
下列有关说法正确的是
A.X的化学式为C4H6O4
B.Y分子中有1个手性碳原子
C.生成聚酯Z的反应类型为加聚反应
D.制备聚酯Z,消耗Y和1,4-丁二醇的物质的量之比为1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列各说法中,正确的是
A.ΔH>0表示放热反应,ΔH<0表示吸热反应
B.热化学方程式中的化学计量数只表示物质的量,可以是分数
C.已知C(s)+![]() O2(g)=CO(g) ΔH=-110.5kJ·mol-1,说明碳的燃烧热为110.5kJ·mol-1
O2(g)=CO(g) ΔH=-110.5kJ·mol-1,说明碳的燃烧热为110.5kJ·mol-1
D.1molH2与0.5molO2反应放出的热就是H2的燃烧热
查看答案和解析>>
科目: 来源: 题型:
【题目】已知6.2克某有机物在氧气中完全燃烧,其产物(100 ℃)依次通过盛有浓硫酸的洗气瓶、盛有碱石灰的干燥管全部被吸收后,洗气瓶的质量增加5.4克,干燥管的质量增加8.8克。
(1)计算确定该有机物的最简式。_________________
(2)相同条件下,若该有机物蒸气相对氢气的密度为31,计算确定该有机物的分子式。_________________
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气是一种重要的物质,可用于制取化肥和硝酸等。已知H-H键、N-H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol。
(1)写出合成氨的热反应方程式__________。生成1 mol NH3需要吸收或放出_______ kJ的热量。
(2)当合成氨反应达到平衡后,改变某一外界条件![]() 不改变N2、H2和NH3的量
不改变N2、H2和NH3的量![]() ,反应速率与时间的关系如图所示图中t1时引起平衡移动的条件可能是_______。其中表示平衡混合物中NH3的含量最高的一段时间是________。
,反应速率与时间的关系如图所示图中t1时引起平衡移动的条件可能是_______。其中表示平衡混合物中NH3的含量最高的一段时间是________。

(3)温度为T0C时,将2a molH2和a molN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%,则该反应的平衡常数为_________。
(4)已知373K时,可逆反应平衡常数为K=0.12,若某时刻时,测得c(N2)=1 mol/L,c(H2)=3 mol/L,c(NH3)=2 mol/L,此时可逆反应_________。
A.向正方向进行 B.向逆方向进行 C处于平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上制备有机氟化剂![]() 的反应
的反应![]() 。下列说法正确的是
。下列说法正确的是
A.NaF既不做氧化剂也不做还原剂,![]() 为氧化产物
为氧化产物
B.![]() 与
与![]() 两种物质中的氯元素化合价不同
两种物质中的氯元素化合价不同
C.还原剂与氧化剂物质的量之比为2:1
D.![]() 属于有机物
属于有机物
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是某课外活动小组在进行探究乙醇性质实验时遇到的问题,请你帮助解决。
(1)在做乙醇与钠反应的实验时,把一小块钠缓慢放入装有乙醇的试管内,与钠和水反应相比有所不同:①钠没有熔化成小球;②钠先沉在试管底;③反应后逐渐浮起。小组同学进行讨论,前两点现象解释达成共识。请说出你的看法:
①钠没有熔化成小球是因为_________________;
②钠先沉在试管底是因为__________________;
③第三点现象解释存在争议,活动小组的同学形成两种意见:a生成的氢气产生浮力所致;b生成的乙醇钠增大了溶液的密度所致。请你设计一个实验验证a和b说法的合理_________
(2)在做乙醇的催化氧化实验中,某同学有个意外发现:在酒精灯外焰上灼烧铜丝观察到铜丝表面变黑;当铜丝接近灯芯,变黑的铜丝又恢复原来的红色。请用化学方程式解释上述变化的过程_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】M、W、X、Y、Z是同周期主族元素,X原子的最外层电子数是W原子次外层电子数的3倍。它们形成的化合物可用作新型电池的电极材料,结构如图所示,化合物中除![]() 外其它原子均满足8电子稳定结构。下列说法正确的是
外其它原子均满足8电子稳定结构。下列说法正确的是
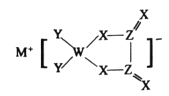
A.M的单质通常保存在煤油中B.W的最高价氧化物对应的水化物是一元弱酸
C.简单气态氢化物稳定性X>YD.上述五种元素中Z的电负性最大
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,反应室(容积恒定为2 L)中有反应:A(g)+2B(g)=C(g)。
(1)能说明上述反应达到平衡状态的是________(填字母,下同)。
A.反应中A与B的物质的量浓度之比为1∶2
B.混合气体总物质的量不再变化
C.混合气体的密度不随时间的变化而变化
D.2v正(A)=v逆(B)
(2)1 mol A(g)与2 mol B(g)在催化剂作用下在反应室反应生成C(g),A的平衡转化率与温度、压强的关系如图所示:
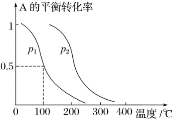
①p1________(填“<”、“>”或“=”,下同)p2,正反应的ΔH________0。
②下列措施中一定能使c(C)/c(A)增大的是________。
A.升高温度 B.恒温恒容再充入A
C.恒温恒容再充入B D.恒温恒容再充入1 mol C
(3)100 ℃时将1 mol A和2 mol B通入反应室,保持温度不变,10 min末C(g)的浓度为0.05 mol·L-1,则10 min末B的转化率为________,此时v正_______v逆(填“<”、“>”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com