
科目: 来源: 题型:
【题目】已知某可逆反应:mA(g)+nB(g)![]() xC(g) ΔΗ=Q kJmol-1,在密闭容器中进行,表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
xC(g) ΔΗ=Q kJmol-1,在密闭容器中进行,表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
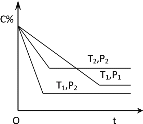
A.T1>T2,P1>P2,m+n>x,Q>0
B.T1<T2,P1<P2,m+n<x,Q>0
C.T1>T2,P1<P2,m+n<x,Q<0
D.T1<T2,P1<P2,m+n>x,Q<0
查看答案和解析>>
科目: 来源: 题型:
【题目】把一小块金属钠投入水中,观察到以下各种现象:钠浮在水面上,熔成闪亮的小球,四处游动,逐渐减少,直至消失。
(1)钠的原子结构示意图为___。
(2)写出该反应的化学方程式___;其中钠熔成闪亮小球的原因是___。
(3)将所得溶液平均分成两份:
①一份加入足量的铝片充分反应,写出该反应的离子方程式:___。
②向另一份溶液中滴加FeCl3溶液至沉淀不再增加,写出生成沉淀的反应的离子方程式___;继续将沉淀过滤、洗涤、干燥、灼烧,此时得到的固体为___(填化学式),如称量其质量为4.0g,通过计算,可知最初加入的金属钠的质量为___g。
查看答案和解析>>
科目: 来源: 题型:
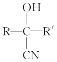
【题目】氯吡格雷是一种用于预防和治疗因血小板高聚集引起的心、脑及其他动脉循环障碍疾病的药物。以A为原料合成该药物的路线如图:

(1)A的化学名称是__,C中的官能团除了氯原子,其他官能团名称为__。
(2)A分子中最少有__原子共面。
(3)C生成D的反应类型为__。
(4)A与新制Cu(OH)2反应的化学方程式为__。
(5)物质G是物质A的同系物,比A多一个碳原子,符合以下条件的G的同分异构体共有__种。
①除苯环之外无其他环状结构;②能发生银镜反应。③苯环上有只有两个取代基。
其中核磁共振氢谱中有4个吸收峰,且峰值比为2∶2∶2∶1的结构简式为__。
(6)已知:
![]()
![]()
 ,写出以苯甲醇为有机原料制备化合物
,写出以苯甲醇为有机原料制备化合物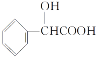 的合成路线(无机试剂任选)__。
的合成路线(无机试剂任选)__。
查看答案和解析>>
科目: 来源: 题型:
【题目】非金属(碳、硅、氯、硫、氮等)及其化合物,是构成自然界的重要物质,在人类的生产和生活中有广泛的应用。
(1)a.碳酸钠、b.氯气、c.氢氧化钠、d.二氧化硅、e.盐酸5种物质中:
①属于盐的是___(填序号);
②水晶的主要成分是___;
③水溶液具有漂白性的是___;
(2)碳酸钠溶于水发生电离,其电离方程式为___。
(3)硅酸钠的水溶液俗称水玻璃,向水玻璃中滴加盐酸立刻生成一种凝胶,写出该凝胶的化学式____。
(4)某化工厂发生氯气泄漏事件,工作人员喷射NaOH溶液形成液幕,包围并吸收泄漏的氯气,其反应原理为___(用化学方程式表示)。
(5)向H2S 饱和溶液中通入氯气,马上出现了淡黄色浑浊,溶液酸性明显增强,请写出该反应的化学方程式____。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸铵[(NH4)2C2O4] 为无色柱状晶体,不稳定 ,受热易分解,可用于测定 Ca2+、Mg2+的含量。
I.某同学利用如图所示实验装置检验草酸铵的分解产物。

(1)实验过程中,观察到浸有酚酞溶液的滤纸变红,装置 B 中澄清石灰水变浑浊,说明分解产物中含有__________________(填化学式);若观察到__________________,说明分解产物中含有 CO。草酸铵分解的化学方程式为______________________。
(2)反应开始前 ,通入氮气的目的是________________________。
(3)装置 C 的作用是_______________________。
(4)还有一种分解产物在一定条件下也能还原CuO , 该反应的化学方程式为__________。
II.该同学利用草酸铵测定血液中钙元素的含量 。
(5)取 20.00 mL 血液样品 ,定容至 l00m L, 分别取三份体积均为25.00 mL 稀释后的血液样品,加入草酸铵,生成草酸钙沉淀,过滤,将该沉淀溶于过量稀硫酸中,然后用 0.0l00mol/L KMnO4 溶液进行滴定。滴定至终点时的实验现象为___________。三次滴定实验消耗 KMnO4 溶液的体积分别为0.43mL , 0.41 m L , 0.52mL, 则该血液样品中钙元素的含量为________m mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的氢气在氯气中燃烧,所得混合物用100mL3.00mol·L-1的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.10mol,则反应的氢气和氯气的物质的量之比n(H2)∶n(Cl2)是( )
A.3:2B.1:3C.4:1D.1:5
查看答案和解析>>
科目: 来源: 题型:
【题目】关于Na2O2与CO2、H2O反应的叙述正确的是( )
A.Na2O2与H2O反应中,Na2O2作氧化剂,H2O作还原剂
B.Na2O2与CO2反应中,Na2O2作还原剂,CO2作氧化剂
C.Na2O2与CO2反应中,1molNa2O2转移2mol电子
D.Na2O2与水反应中,1molNa2O2转移1mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定乙醇的结构式,有人设计了用无水酒精与钠反应的实验装置和测定氢气体积的装置进行实验。可供选用的实验仪器如图所示。
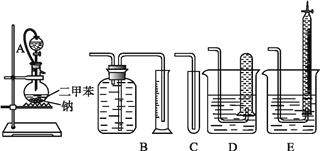
请回答以下问题:
(1)测量氢气体积的最好装置是_____(填编号)。
(2)装置中A部分的分液漏斗与烧瓶之间连接的导管所起的作用是___(填编号)。
A.防止无水酒精挥发
B.保证实验装置不漏气
C.使无水酒精顺利滴下
(3)实验前预先将小块钠在二甲苯中熔化成若干个小钠珠,冷却后倒入烧瓶中,其目的是____。
(4)已知无水酒精的密度为0.789 g·cm3,移取2.0 mL酒精,反应完全后(钠过量),收集到390 mL(视作标准状况)气体。则一个乙醇分子中能被钠取代的氢原子数为___,由此可确定乙醇的结构式为_________,而不是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将 0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H = -38.6kJ·mol-1
2NH3(g) △H = -38.6kJ·mol-1
C.HCl 和 NaOH 反应的中和热△H=-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热 △H = 2×(-57.3)kJ·mol -1
D.在101kPa 时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1) △H =-571.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】
教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_____种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA ~ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________。判断依据是____________。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_____________晶体。

(4)第一电离能介于Al、P之间的第三周期元素有____种。 GaCl3中中心原子的杂化方式为_________,写出与GaCl3结构相同的一种等电子体(写离子)______________。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有__________个紧邻分子。 D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_____________(填字母标号)。

a.极性键 b.非极性键 c.配位键 d.金属键
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是_____(填字母标号)。


铁原子的配位数是____________,假设铁原子的半径是r cm,该晶体的密度是ρg/cm3 ,则铁的相对原子质量为________________(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com