
科目: 来源: 题型:
【题目】如图所示为某研究性学习小组探究金属腐蚀条件的实验装置图,试分析实验并回答下列问题:
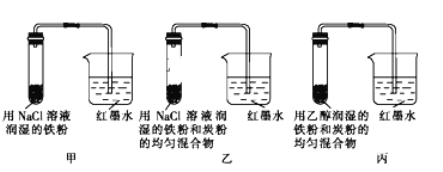
(1)起始时若甲、乙、丙三套装置的导管中液面高度相同,则过一段时间后导管中液面最高的是_____(填装置代号).
(2)通过甲、乙装置的对比实验说明,钢铁中碳的含量越_____(填“高”或“低”)越容易被腐蚀.
(3)乙装置中发生电化学腐蚀时正极的电极反应式为_____.
(4)为防止铁的锈蚀,工业上普遍采用的方法是_____(写出一点即可).
查看答案和解析>>
科目: 来源: 题型:
【题目】同主族元素形成的同一类型的化合物,往往结构和性质很相似,如PH4I的结构和性质与NH4Cl相似,有关PH4I的叙述中不正确的是( )
A.可由PH3与HI化合生成
B.PH4I为离子型化合物
C.能跟NaOH溶液反应
D.电子式为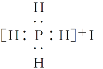
查看答案和解析>>
科目: 来源: 题型:
【题目】通常监测SO2含量是否达到排放标准的反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl。NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1 molBaCl2晶体中所含离子总数为0.1NA
B.25℃时,pH=1的HCl溶液中含有H+ 的数目为0.1NA
C.l7g H2O2中含有非极性键数目为0.5NA
D.生成2.33gBaSO4沉淀时,转移电子数目为0.01NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学进行了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如下(见表格),请结合表中信息,回答有关问题:
实验序号 | 反应温度/ | 参加反应的物质 | ||||
|
|
| ||||
|
|
|
|
| ||
A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
(1)根据你所掌握的知识判断,在上述实验中,反应速率最快的实验可能是__________(填实验序号)。
(2)在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件。其中:
①能说明温度对该反应速率影响的组合是__________(填实验序号);
②A和B、A和C的组合比较,所研究的问题是___________________________________________;
③B和C的组合比较,所研究的问题是___________________________________________。
(3)实验中利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用测量单位时间内产生气体体积的大小进行比较:___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A.NH4HCO3溶于过量的浓KOH溶液中:HCO![]() +2OH-=CO
+2OH-=CO![]() + H2O
+ H2O
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO![]() 沉淀完全:2Al3++3SO
沉淀完全:2Al3++3SO![]() +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.向FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2 Fe3++Br2+4 Cl-
D.向氢氧化铁中加入HI溶液:2Fe(OH)3+6H+ +2I—= 2Fe2+ + I2 +6 H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷燃料电池以KOH溶液为电解质,其总反应的化学方程式为:CH4+2O2+2OH-===CO32—+3H2O。
(1)负极上的电极反应为____________________________________。
(2)消耗标准状况下的5.6 L O2时,有________ mol电子发生转移。
(3)开始放电时,正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示,下列说法正确的是( )
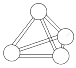
A. N4分子属于一种新型的化合物B. N4分子中只含有非极性键
C. 1 mol N4分子所含共价键数为4NAD. N4沸点比P4(白磷)高
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 在标准状况下.11.2L丙烷含有的极性键数目为5NA
B. 7g锂在空气中完全燃烧时转移的电子数为NA
C. 1mol葡萄糖(C6H12O6)分子含有的羟基数目为6NA
D. 常温下,0.2L0.5mol/LNH4NO3溶液中含有的氮原子数小于0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题:
(1)2 mol CO(NH2)2中含_____molN原子, 所含O原子数跟________g H2O所含氧原子数相等。
(2)12.4 g Na2R含Na+0.4 mol,则Na2R的摩尔质量为_______,含R的质量为1.6 g的Na2R,其物质的量为_________。
(3)CO和CO2的混合气体18 g,在标准状况下的体积为11.2 L,则混合气体的平均摩尔质量为________,混合气体中CO的质量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如图所示:
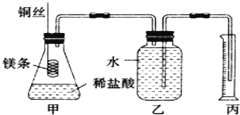
该实验的主要操作步骤如下:
①用已知浓度的浓盐酸配制100mL 1.0mol/L的盐酸溶液,需要用到的仪器有量筒、烧杯、玻璃棒、胶头滴管、______;
②用10mL量筒量取8.0mL 1.0mol/L的盐酸溶液加入锥形瓶中;
③准确称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为______;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,忽略导管中的水,读出量筒中水的体积为VmL。
请回答下列问题。
(1)步骤①中,配制100mL 1.0mol/L的盐酸溶液时,下列哪些操作会使配制浓度偏低_____(填写字母)
A. 用量筒量取浓盐酸时,俯视量筒的刻度
B. 容量瓶未干燥即用来配制溶液
C. 未洗涤烧杯和玻璃棒
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线
E.在容量瓶中定容时俯视容量瓶刻度线
(2)请填写操作步骤中的空格:步骤①__________ 步骤③__________
(3)实验步骤⑤中应选用________的量筒(填字母).
A.100mL B.200mL C.500mL
(4)读数时需要注意(至少写两点)____________
(5)忽略水蒸气影响,在该条件下测得气体摩尔体积为Vm=____L/mol。(用含V的式子表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com