
科目: 来源: 题型:
【题目】下图中的实线表示元素周期表的边界。①~⑧分别表示元素周期表中对应位置的元素。
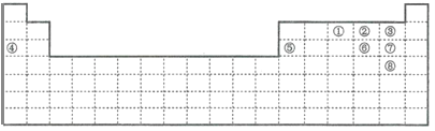
(1)元素周期表体现了元素周期律。元素周期律的本质是________。在元素周期表中,元素的位置与结构的关系是______。
(2)在上表中画出金属区和非金属区的分界线_______
(3)上述元素所能形成的简单离子中半径最小的是________(填离子符号),最高价氧化物对应水化物酸性最强的是________(填分子式)。
(4)④与⑥形成的化合物溶于水后,溶液的pH________7。原因________________(用离子方程式表示),若使其熔化,需破坏的作用力有________________。
(5)元素①的氢化物电子式为________________,该分子属于________晶体。
(6)⑥⑦两元素非金属性较强的是(写元素符号)________。写出能证明这一结论的一个实验事实____。
(7)⑤、⑦各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为____。
(8)⑦的氢化物的还原性比元素⑥的氢化物的还原性________(填“强”或“弱”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将溶液(或气体)Y逐滴加入(或通入)一定量的溶液X中(下表),产生沉淀的物质的量(用纵坐标表示)与加入Y物质的量(用横坐标表示)的关系如图所示,则符合图中所示关系的一组物质是

A | B | C | D | |
X |
|
|
|
|
Y |
|
| NaOH | HCl |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】同主族元素所形成的同一类型的化合物,往往其结构和性质相似。化合物![]() 是一种晶体,下列对它的叙述中,错误的是
是一种晶体,下列对它的叙述中,错误的是
A.它是一种离子化合物
B.这种化合物水溶液显中性
C.这种化合物加热能分解
D.这种化合物能与氢氧化钠溶液发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】同一主族的X,Y,Z三种元素,已知其最高价含氧酸的钠盐溶液,等物质的量浓度时,溶液的pH大小为![]() ,则下列推断正确的是
,则下列推断正确的是
A.元素的非金属性强弱![]() B.相对原子质量
B.相对原子质量![]()
C.阴离子的还原性![]() D.气态氢化物稳定性
D.气态氢化物稳定性![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】根据你对金属钠性质的了解,回答下列问题:
(1)关于钠的叙述中,正确的是________(填字母)。
A.钠是银白色金属,硬度很大
B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,产生黄色火焰,生成过氧化钠
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
(2)由于金属钠很容易跟空气中的______、________等物质反应,通常将它保存在_______里。
(3)将一小块钠投入到下列溶液中,既能产生气体又会出现白色沉淀的是________(填字母)。
A.稀硫酸 B.硫酸铜溶液
C.氢氧化钠溶液 D.氯化镁溶液
(4)为粗略测定金属钠的相对原子质量,设计的装置如图所示,该装置(包括水)的总质量为ag,将质量为bg的钠(不足量)放入水中,立即塞紧瓶塞。完全反应后再称量此装置的总质量为cg。
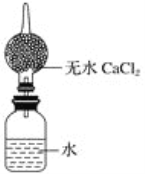
①列出计算钠相对原子质量的数学表达式______________(用含有a、b、c的算式表示)。
②无水氯化钙的作用是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】不用任何试剂,只用试管和胶头滴管就可以鉴别开来的一组是:(1)![]() 溶液和
溶液和![]() 溶液(2)NaOH溶液和
溶液(2)NaOH溶液和![]() 溶液(3)HCl溶液和
溶液(3)HCl溶液和![]() 溶液(4)
溶液(4)![]() 溶液和氨水溶液
溶液和氨水溶液
A.(1)(2)(3)B.(2)(3)(4)C.(1)(2)D.(2)(3)
查看答案和解析>>
科目: 来源: 题型:
【题目】烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液,并用于烟气脱硫研究。
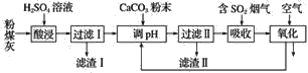
(1)酸浸时反应的化学方程式为_______________________________________________;滤渣Ⅰ的主要成分为________(填化学式)。
(2)滤渣Ⅱ的主要成分为________(填化学式);制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液的化学方程式为_________________________________________________________________。
(3)吸收烟气中SO2的化学方程式为Al2(SO4)3·Al2O3+3SO2=Al2(SO4)3·Al2(SO3)3。通入空气氧化,发生反应的化学方程式为_______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下:
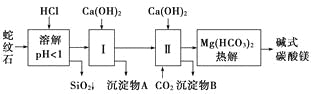
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是__________________。
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)。
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 1.5 | 3.3 | 9.4 |
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致________溶解、________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入______________________________________________________________(填入物质的化学式),
然后______________________________________________________________________(依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是________(填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量
②高温分解
③________________________________________________________________________
④________________________________________________________________________
⑤MgO称量
(6)18.2 g产品完全分解后,产生6.6 g CO2和8.0 g MgO,由此可知,产品的化学式中:
a=________,b=________,c=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝是国民经济发展的重要材料,铝在地壳中的含量约占8%,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(Ⅰ)实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:Al![]() Al3+
Al3+![]() Al(OH)3↓
Al(OH)3↓
方案2:Al![]() AlO
AlO![]()
![]() Al(OH)3↓
Al(OH)3↓
方案3: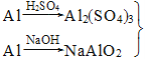 ―→Al(OH)3
―→Al(OH)3
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案________。
(Ⅱ)工业上冶炼铝的流程图如图所示:
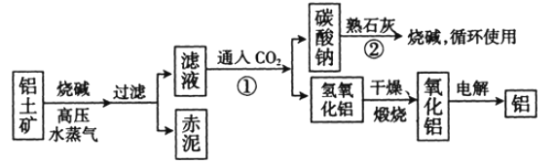
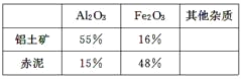
在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe2O3质量分数的数据如下:
(1)书写化学方程式,反应①________,反应②________。
(2)电解氧化铝生产铝时,阳极的电极反应式为_______________________________________。
(3)假设其他杂质不参加反应,则每生产3.4 t纯净的氧化铝,需铝土矿________t。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com