
科目: 来源: 题型:
【题目】随原子序数的递增,八种短周期元素的原子半径的相对大小、最高正价或最低负价的变化如下图所示,下列分析正确的是( )
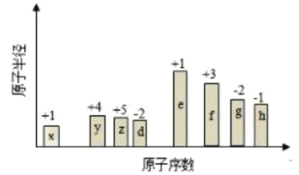
A.![]() 、
、![]() 的简单离子半径大小:
的简单离子半径大小:![]()
B.元素的金属性:![]()
C.元素的非金属性:![]()
D.![]() 、
、![]() 、
、![]() 和
和![]() 四种元素能形成离子化合物
四种元素能形成离子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组探究铁与氯气的反应途径及产物。
(问题提出)
(1)资料1:液氯能在钢瓶中储存。
资料2:铁与氯气在加热条件下能发生反应
资料3:铁与氯水能反应。实验:将铁粉放入氯水中,铁粉溶解,无气泡产生。
①经检验氯水呈酸性,原因是________(用化学方程式表示)。
②依据实验现象,判断氯水中与Fe反应的微粒可能为_________。
据此,小组认为Fe与Cl2的反应与温度、湿度有关,探究如下。
(实验探究) 资料:高于300℃时FeCl3升华
(2)湿润的Cl2与Fe的反应:
实验 | 装置 | 操作及现象 |
Ⅰ |
| 常温时将铁丝伸入A中,铁丝迅速变黑 |
Ⅱ | 将红热的铁丝伸入A中,铁丝剧烈燃烧,产生大量棕黄色烟。 |
①实验Ⅰ,向A中加水,经检验产物中有FeCl2,推测其形成的可能途径:
途径一: Fe + Cl2 = FeCl2
途径二: 2Fe + 3Cl2 = 2FeCl3,_________。
②实验Ⅱ,_________(填操作和现象),A中产物含+3价铁。
(3)干燥的Cl2与Fe的反应:
实验 | 装置 | 操作及现象 |
Ⅲ |
| 常温时将铁丝伸入A中, 铁丝慢慢变 黑,大量气体剩余。 |
Ⅳ | 将红热的铁丝伸入A中,铁丝剧烈燃烧,产生大量棕黄色烟。 |
实验Ⅲ中有大量Cl2剩余,实验Ⅳ几乎无Cl2剩余,原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝、锌、铁在人类生产和生活中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Fe2+电子排布式为___,Zn的基态原子能级最高的电子的电子云轮廓图形状为___。
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因___。
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键___mol,其阴离子中心原子的杂化方式是___,NH3的沸点高于PH3的原因是___。
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:___。
(5)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为___,其中Fe的配位数为___。
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xcm,高为ycm,NA为阿伏加德罗常数的值,则晶胞的密度为___g·cm-3(列出计算式即可)。
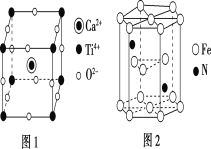
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1 NaHCO3溶液中:NH![]() 、H+、NO
、H+、NO![]() 、SO
、SO![]()
B.使酚酞变红色的溶液中:Mg2+、Fe2+、NO![]() 、Cl-
、Cl-
C.0.1 mol·L-1 FeCl3溶液中:K+、Na+、Br-、SCN-
D.c(H+)=1×10-4 mol·L-1的溶液中:K+、Cu2+、Cl-、SO![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】用Cl2和Ca(OH)2制备少量漂粉精(一种含氯消毒剂)的装置如下。
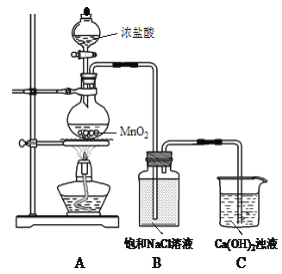
(1)A为氯气发生装置。A中反应方程式是________。
(2)B的作用是吸收挥发出的HCl。HCl可能对制备漂粉精造成的影响是________。
(3)用Cl2和Ca(OH)2制备的漂粉精,其有效成分是_________。
(4)漂粉精常用于游泳池的消毒,起消毒作用的是HClO。漂粉精在水中释放HClO的途径如下:
途径一:Ca(ClO)2 + 2H2O Ca(OH)2 + 2HClO
途径二:Ca(ClO)2 + H2O + CO2 =________+ _______(把反应补充完整)
(5)池水的酸碱性对漂粉精的消毒效果影响明显。
①池水碱性过强,杀毒作用会________(填“增强”或“减弱”)。
②池水酸性过强,会刺激眼睛和皮肤。通常加入Na2CO3、NaHCO3以降低酸性,起到降低酸性作用的离子分别是________(填离子符号)。
(6)某届奥运会期间,发生了室外游泳池水变绿的事件,成为当时的一大新闻。有关负
责人说,池水变绿是藻类生长造成的。该游泳池每隔一段时间就要投放含氯消毒剂,当再次投放时,误投了过氧化氢(H2O2)消毒剂。消毒剂为什么不起作用了?_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中c(Cl—)与c(SO42—)之比为( )

A. 1∶1 B. 2∶3 C. 3∶2 D. 2∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】测定CuSO4·xH2O 晶体的x值,数据如表中所示,已知x的理论值为5.0,产生误差的可能原因是( )
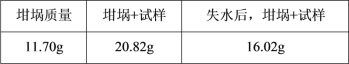
A.晶体中含不挥发杂质B.未做恒重操作
C.加热前晶体未研磨D.加热时有晶体溅出
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关烷烃的叙述中,不正确的是( )
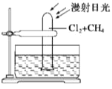
A.在烷烃分子中,所有的化学键都为单键
B.烷烃在光照条件下一般都能与Cl2发生取代反应
C.如图所示,将1体积甲烷和4体积Cl2充入试管中,
一段时间后,将看到水槽底部有油状液滴生成,试管内充满水
D.甲烷与Cl2在光照条件下发生反应的产物中,HCl在水槽中的浓度最大
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂(LiFePO4)。LiFePO4的一种制备方法如下。

已知:H3PO4能电离出PO43-。
(1)Li在元素周期表中的位置是________。
(2)LiFePO4中,铁元素的化合价为________价。
(3)将反应Ⅰ补充完整:____Fe2+ + 2H+ + ____H2O2 =____Fe3+ + 2H2O 。____
(4)反应Ⅲ的化学方程式是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】全氮类物质因具有超高能量而成为超高含能材料的典型代表。我国科学家成功合成了全氮阴离子盐——(N5)6(H3O)3(NH4)4Cl,是该领域的重大突破。
(1)氮的原子结构示意图为________。
(2)构成该全氮阴离子盐的离子是Cl-、H3O+、NH4+和________。
(3)氯与氢之间的作用对全氮阴离子盐的稳定性起着至关重要的作用。结合原子结构解释氯元素非金属性强的原因:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com