
科目: 来源: 题型:
【题目】在l0℃时,10 mL 0.4 mol L-1H2O2溶液发生催化分解:2H2O2![]() 2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 |
下列叙述不正确的是(溶液体积变化忽略不计)
A. 0~2 min的平均反应速率比4~6 min快
B. 0~6 min 的平均反应速率v(H2O2)=3.3×10-2 moL-1 L-1 min-1
C. 反应至 6 min 时,c(H2O2)=0.3 mol·L-1
D. 反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目: 来源: 题型:
【题目】对于4NH3(g) + 3O2(g) = 2N2(g) + 6 H2O(g) 的反应来说,以下化学反应速率的表示中反应速率最快的是
A. v(NH3)=0.6 mol L-1min-1B. v(O2) =0.4 mol L-1min-1
C. v(N2)=0.2 mol L-1min-1D. v(H2O) =0.3 mol L-1min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】研究发现,曾用于抗击埃博拉冠状病毒的新药瑞德西韦(Remdesivir)对新型冠状病毒(2019-nCoV)有抑制作用。K为合成该药物的中间体,其合成路线如图:

已知:(R代表烃基或其它基团)
①R—OH![]() R—Cl
R—Cl
②R—CHO![]() R—CH(CN)—OH
R—CH(CN)—OH![]() R—CH(CN)—NH2
R—CH(CN)—NH2![]() R—CH(NH2)COOH
R—CH(NH2)COOH
回答下列问题:
(1)芳香化合物A的名称为_____。
(2)B到C的反应类型是_____。
(3)由G生成H反应的化学方程式为_____。
(4)已知E中含两个Cl原子,则E的结构简式为_____。
(5)J中含氧官能团的名称为_____。
(6)X是C的同分异构体,满足下列条件的X共_____种,其中核磁共振氢谱中有4个峰的X的结构简式是_____。
①苯环上连有3个取代基,其中一个为氨基;
②1mol的X与足量烧碱溶液作用时,会消耗4molNaOH。
(7)设计由苯甲醛为原料制备化合物 的合成路线_____(溶剂、无机试剂任选)。
的合成路线_____(溶剂、无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组研究Cu与浓硝酸反应时发现如下现象:
装置与试剂 | 现象 |
| Cu片完全溶解,产生红棕色气体,得到绿色溶液A,该溶液长时间放置后得到蓝色溶液B。反应后溶液体积几乎不变。 |
(1)Cu与浓硝酸反应的离子方程式为_____。
(2)甲同学猜测溶液A不是蓝色而呈绿色与溶解了NO2有关,于是向溶液B中通入NO2,然后再持续通入一段时间N2,观察到现象:_____,证实猜测合理。
甲同学为深入研究溶液A呈绿色的原因,查得如下资料并提出了新的假设:

假设一:A中形成了Cu(NO2)![]() 使溶液呈绿色。
使溶液呈绿色。
为了验证假设一的合理性,甲同学进行了如下实验:
(实验一)
操作 | 现象 |
①向20.0mL0.5mol·L-1Cu(NO3)2蓝色溶液中通入少量NO2气体 | 溶液呈绿色 |
②向20.0mL水中通入与①中等量的NO2气体 | 溶液呈无色 |
(3)操作②的目的是_____。
(4)乙同学向①所得溶液中滴加浓硫酸,使溶液中c(H+)达约8mol·L-1,观察到有无色气体放出(遇空气变为红棕色),溶液很快变回蓝色。利用平衡移动原理解释溶液变蓝的原因:_____。
(5)综合甲乙两位同学的实验,假设一不成立。请说明理由:______。
乙同学查得如下资料并提出来另一种假设:
![]()
假设二:A中浓硝酸溶解了NO2所得黄色溶液与Cu2+的蓝色复合形成的绿色。
为验证假设二的合理性,乙同学进行了如下实验:
(实验二)
操作 | 现象 |
①配制与溶液A的c(H+)浓度相同的HNO3溶液,取20.0mL,通入少量NO2气体 | 溶液呈黄色 |
②加入 | 溶液变为绿色 |
③…… | 溶液立即变回蓝色 |
(6)操作②中加入的试剂为_____。
操作③进一步证明了假设二的合理性,写出该操作:span>_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃、101 kPa时,1 g甲醇(CH3OH)完全燃烧生成CO2和液态H2O,同时放出22.68 kJ热量。下列表示该反应的热化学方程式中正确的是( )
A.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-725.8 kJ/mol
O2(g)=CO2(g)+2H2O(l) ΔH=-725.8 kJ/mol
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=+1 451.6 kJ/mol
C.2CH3OH+3O2=2CO2+4H2O(l) ΔH=-22.68 kJ/mol
D.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-725.8 kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH=-725.8 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】“84消毒液”为含氯消毒剂的代表被广泛使用,化学小组用如下方法测定某“84消毒液”中有效氯的含量。
I.准确量取2.00mL消毒液稀释成100.0mL溶液;
II.取1.00mL上述稀释后溶液,依次加入3mol·L-1硫酸溶液15mL、15.00mL一定浓度的Fe2+溶液,加盖振摇混匀后,室温静置反应10min;
III.用0.0010mol·L-1的标准K2Cr2O7溶液滴定II中反应后溶液,记录消耗的体积为VmL;
IV.另取与II中相同的15.00mL一定浓度的Fe2+溶液,依次加入1.00mL蒸馏水、3mol·L-1硫酸溶液15mL,加盖振摇混匀;
V.用0.0010mol·L-1的标准K2Cr2O7溶液滴定IV中溶液,记录消耗的体积为V0mL。
(1)工业上制取“84消毒液”反应的化学方程式为_______。
(2)Ⅰ中稀释溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和______。
(3)用KSCN溶液检测到II反应后溶液中含有Fe3+的现象是______,Ⅱ中反应的离子方程式为______。
(4)Ⅲ中发生反应的离子方程式是_____(Cr2O![]() 转化为Cr3+,此条件下不氧化Cl-)。
转化为Cr3+,此条件下不氧化Cl-)。
(5)该“84消毒液”中有效氯的含量为_____ g/100mL。(有效氯以NaClO质量计,NaClO摩尔质量:74.5g·mol-1)
(6)由于Fe2+具有_____性,II、IV中实验须在密闭容器中进行。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式中的反应热下划线处表示燃烧热的是 ( )
A.NH3(g) +![]() O2(g) = NO(g) +
O2(g) = NO(g) +![]() H2O(g) ΔH=-a kJ·mol-1
H2O(g) ΔH=-a kJ·mol-1
B.C6H12O6(s) + 6O2(g) = 6CO2(g) + 6H2O(g) ΔH=-b kJ·mol-1
C.CO(g) +![]() O2(g) = CO2(g) ΔH=-c kJ·mol-1
O2(g) = CO2(g) ΔH=-c kJ·mol-1
D.CH3CH2OH(l) +![]() O2(g) = CH3CHO(l) + H2O(l) ΔH=-d kJ·mol-1
O2(g) = CH3CHO(l) + H2O(l) ΔH=-d kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在2 L密闭容器中发生反应:A(g)+3B(g) === 2C(g) + 4D(g),测得5 min内,A的物质的量减小了10 mol,则5 min内该反应的化学反应速率是
A. υ(A) = 1 mol/(L·min)
B. υ(B) = 1 mol/(L·min)
C. υ(C) = 1 mol/(L·min)
D. υ(D) = 1 mol/(L·min)
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中进行如下反应:2SO2(g) +O2(g) ![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达平衡时,可能存在的数据是
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达平衡时,可能存在的数据是
A. SO2为0.4mol/L
B. SO2为 0.25mol/L
C. SO2、SO3均为0.15mol/L
D. SO3为0.4mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,我国秋冬季雾霾天气呈现常态化趋势,造成严重空气污染,对人类身心健康造成极大威胁。硫酸盐气溶胶作为PM2.5的主要构成成分,是雾霾产生的一个重要元凶。科学家最近发现了一种利用水催化促进硫酸盐形成的化学新机制。如图所示:
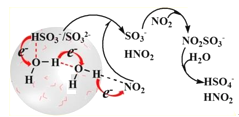
(1)NO2和SO2作为大气初期污染物的主要成分,主要来自_____。
(2)电子传递可以促进HSO![]() 中O—H键的解离,进而形成中间体SO
中O—H键的解离,进而形成中间体SO![]() ,反应的离子方程式为_____。
,反应的离子方程式为_____。
(3)通过“水分子桥”,处于纳米液滴中的SO![]() 或HSO
或HSO![]() 可以将电子快速转移到周围的气相NO2分子。观察图示可知“水桥”主要靠____形成。写出HSO
可以将电子快速转移到周围的气相NO2分子。观察图示可知“水桥”主要靠____形成。写出HSO![]() 与NO2间发生的总反应的离子方程式:_____。
与NO2间发生的总反应的离子方程式:_____。
(4)亚硝酸(HNO2)是一种弱酸,酸性比醋酸稍强,极不稳定,只能存在于稀的水溶液中,加热时发生歧化反应,生成一种强酸和一种遇空气变为红棕色的气体,写出该反应的化学方程式:_____。
(5)结合题中信息,请写出一种鉴别NaNO2和NaCl的方法:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com