
科目: 来源: 题型:
【题目】一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g) + O2(g)![]() 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | t1 | t2 | t3 | t4 |
n(SO3) / mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是
A.反应在前t1s 的平均速率v(O2) = 0.4/t1mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)增大
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2与Na2S溶液反应的产物中含有Cl-和SO32-,某课外实验小组为了探究两溶液反应的产物中不含SO32-而含有Cl-,设计了如下实验:
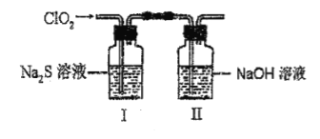
(1)在装置II中NaOH溶液的作用是___,ClO2和NaOH溶液反应生成等物质的量的两种盐,其中一种盐为NaClO2,写出该反应的离子方程式___。
(2)请补充完整实验步骤:把用氮气稀释后的足量ClO2通入I中的Na2S溶液中充分反应,得到无色澄清溶液。
i取少量I中的溶液于试管甲中,滴加品红溶液和盐酸,品红不褪色,证明溶液中无SO2。
ii另取少量I中的溶液于试管乙中,___,证明溶液中含有Cl-。
查看答案和解析>>
科目: 来源: 题型:
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。回答下列问题:
CH3NH2(g)+H2O(g) ΔH。回答下列问题:
(1)上述反应中所需的甲醇工业上利用水煤气合成,已知
①CO(g)+![]() O2(g)═CO2(g) △H1=-284kJ/mol
O2(g)═CO2(g) △H1=-284kJ/mol
②H2(g)+![]() O2(g)═H2O(g) △H2=-248kJ/mol
O2(g)═H2O(g) △H2=-248kJ/mol
③CH3OH(g)+![]() O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
CO(g)+2H2(g)![]() CH3OH(g)ΔH=___。
CH3OH(g)ΔH=___。
(2)在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
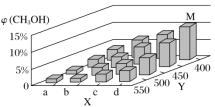
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为____。
②X轴上b点的数值比a点___(填“大”或“小”)。某同学认为图中Y轴表示温度,你认为他判断的理由是___。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,则Ksp(PbI2)=___;已知Ksp(PbCl2)=1.6×10-5,则转化反应PbI2(s)+2Cl-(aq)![]() PbCl2(s)+2I-(aq)的平衡常数K=___。
PbCl2(s)+2I-(aq)的平衡常数K=___。
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:
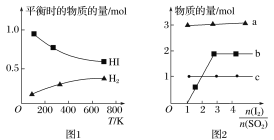
①反应H2(g)+I2(g)![]() 2HI(g)的ΔH__(填大于或小于)0。
2HI(g)的ΔH__(填大于或小于)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O![]() 3H++HSO4-+2I-,I2+I-
3H++HSO4-+2I-,I2+I-![]() I3-,图2中曲线a、b分别代表的微粒是___、___(填微粒符号);由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
I3-,图2中曲线a、b分别代表的微粒是___、___(填微粒符号);由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学探究溶液的酸碱性对FeCl3水解平衡的影响,实验方案如下:配制50 mL 0.001 mol/L FeCl3溶液、50mL对照组溶液x,向两种溶液中分别滴加1滴1 mol/L HCl溶液、1滴1 mol/L NaOH 溶液,测得溶液pH随时间变化的曲线如下图所示。
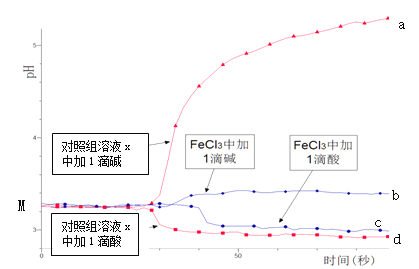
下列说法不正确的是
A.依据M点对应的pH,说明Fe3+发生了水解反应
B.对照组溶液x的组成可能是0.003 mol/L KCl
C.依据曲线c和d说明Fe3+水解平衡发生了移动
D.通过仪器检测体系浑浊度的变化,可表征水解平衡移动的方向
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个固定容积的密闭容器中,可发生以下反应:A(g)+B(g)![]() xC(g);H=?符合下图(a)所示的关系。w(c)为C的质量分数,由此推断关于图(b)的说法正确的是
xC(g);H=?符合下图(a)所示的关系。w(c)为C的质量分数,由此推断关于图(b)的说法正确的是

A.P3>P4,y轴表示A的转化率
B.P3<P4,y轴表示B的体积分数
C.P3<P4,y轴表示混合气体的平均相对分子质量
D.P3>P4,y轴表示混合气体的密度
查看答案和解析>>
科目: 来源: 题型:
【题目】MnO2是一种重要的无机材料,某设计小组将粗MnO2样品(含有较多的MnO和MnCO3)转化为纯MnO2进行实验,其流程如图所示,下列说法正确的是( )
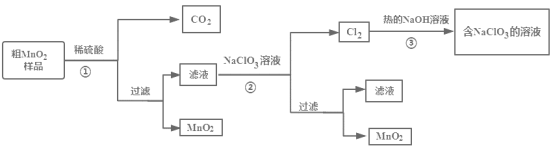
A.步骤①中加稀H2SO4,粗MnO2样品中的MnO2、MnO和MnCO3均转化为可溶物质
B.步骤②反应离子方程式为:5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+
C.步骤③反应后得到的溶液中溶质主要是NaClO3、NaOH
D.该流程中可以循环利用的物质只有NaClO3
查看答案和解析>>
科目: 来源: 题型:
【题目】检验某溶液中是否含有![]() ,常用的方法是( )
,常用的方法是( )
A.取样,滴加BaCl2溶液,看是否有不溶于水的白色沉淀生成
B.取样,滴加稀盐酸酸化的BaCl2溶液,看是否有不落于水的白色沉淀生成
C.取样,滴加稀硫酸,再滴加BaCl2溶液,看是否有不落于水的白色沉淀生成
D.取样,滴加稀盐酸,无明显现象,再滴加BaCl2落液,看是否有不溶于水的白色沉淀生成
查看答案和解析>>
科目: 来源: 题型:
【题目】用KOH为电解质的循环阳极锌空气二次电池放电时的总反应为2Zn+O2=2ZnO,工作时,用泵将锌粉与电解液形成的浆料输入电池内部发生反应,反应所生成的产物随浆料流出电池后,被送至电池外部的电解槽中,经还原处理后再送入电池;循环阳极锌-空气二次电池工作流程图如图所示。下列说法错误的是( )

A.放电时,电池正极反应为O2+4e-+2H2O=4OH-
B.放电时,电解质中会生成少量碳酸盐
C.电池停止工作时,锌粉与电解质溶液不反应
D.充电时,电解槽阴极反应为ZnO+2e-+H2O=Zn+2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组制备84消毒液(主要成分NaClO)设计了如图装置。并查阅到下列资料:

Ⅰ.氯气与水的反应是放热反应;
Ⅱ.卤素单质与碱液发生反应:3X2+6OH-![]() 5X-+XO3-+3H2O。
5X-+XO3-+3H2O。
回答下列问题:
(1)装置中的大试管内发生反应的离子方程式为__。
(2)装置中能否省去盛饱和NaCl溶液的洗气瓶?__(填“能”或“不能”,下同),理由是__。
(3)装置中能否省去盛浓硫酸的洗气瓶?__,理由是__。
(4)装置中能否省去盛冰水的烧杯?__,理由是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com