
科目: 来源: 题型:
【题目】我国科研工作者发展了阴极还原电沉积制备高性能氧化铈电极材料的新方法。以石墨为电极,经历以下过程:①在电场的作用下,将电解液中的硝酸根离子插入石墨层间;②改变电流方向,已插入的和到达电极附近的NO3-放电,产生OH-和NO![]() ;③OH-与Ce3+结合形成氢氧化铈,氢氧化铈进一步失水氧化形成氧化铈(CeO2)。图示如图。已知298K时,Ksp[Ce(OH)3]=1×10-20,当离子浓度≤10-5mol·L-1时,可认为沉淀完全。下列说法错误的是( )
;③OH-与Ce3+结合形成氢氧化铈,氢氧化铈进一步失水氧化形成氧化铈(CeO2)。图示如图。已知298K时,Ksp[Ce(OH)3]=1×10-20,当离子浓度≤10-5mol·L-1时,可认为沉淀完全。下列说法错误的是( )
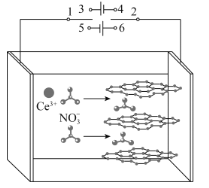
A.过程①,1接3,2接4;过程②,1接5,2接6
B.过程②,阴极电极反应为NO![]() +H2O+2e-=2OH-+NO
+H2O+2e-=2OH-+NO![]()
C.室温下,要保证电解液中Ce3+沉淀完全,阴极附近溶液的pH应不小于9
D.过程③,发生的反应为Ce3++3OH-=Ce(OH)3↓,4Ce(OH)3+O2=4CeO2+6H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是

A. a为直流电源的负极
B. 阴极的电极反应式为2HSO3-+2H++e-=S2O42-+2H2O
C. 阳极的电极反应式为SO2+2H2O-2e-=SO42-+4H+
D. 电解时,H+由阴极室通过阳离子交换膜到阳极室
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,用0.1mol·L-1的盐酸滴定10mL0.1mol·L-1的Na2SO3溶液,滴定曲线如图所示(不考虑滴定过程中SO2的逸出)。下列说法错误的是( )

A.a点由水电离出的氢离子浓度大于d点由水电离出的氢离子浓度
B.0.05mol·L-1NaHSO3溶液的pH=4.25
C.c点时,c(Na+)>c(Cl-)>c(HSO![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.d点时,c(H2SO3)>c(HSO![]() )>c(SO
)>c(SO![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸锶(SrCO3)可用于制造彩电阴极射线管、荧光玻璃等。以天青石(主要含有SrSO4和少量MgCO3杂质)为原料生产SrCO3的流程如图:
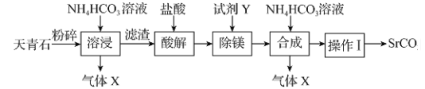
下列说法错误的是( )
A.锶的金属性比钙的强,所以SrSO4的溶解性比CaSO4的强
B.气体X和SO2均为酸性氧化物,且均能使紫色石蕊试液变红
C.“除镁”时,试剂Y可以选用苛性钠
D.“操作I”的母液经蒸发浓缩、冷却结晶可得到铵态氮肥
查看答案和解析>>
科目: 来源: 题型:
【题目】制备氮化镁的装置如图所示。实验时在不锈钢舟内加入镁粉,通氮气15min,升温至1073K,加热半小时,冷却至室温,停止通氮气。下列说法正确的是( )
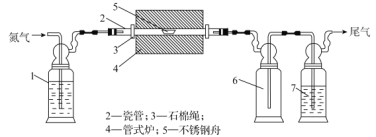
A.1中的试剂是饱和食盐水,便于观察气泡,调节气流速度
B.6的作用是缓冲加热后未反应的氮气,7的作用是防止空气中的水分进入装置
C.氮化镁是共价化合物,露置于空气中有刺激性气味的气体产生
D.实验中氮气是反应物,仅起到氧化镁粉的作用
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物甲的分子式为C4H9Br,在适宜的条件下能发生如下转化关系:
B![]() A
A![]() 甲(C4H9Br)
甲(C4H9Br)![]() D
D![]() E
E
已知:B能发生银镜反应,核磁共振氢谱显示其有三个吸收峰。试回答下列问题:
(1)甲的名称:____。甲生成A的反应类型是___。
(2)B与新制氢氧化铜悬浊液反应的化学方程式:____。
(3)甲与NaOH醇溶液共热的化学方程式为:___。
(4)A的同类同分异构体中,不能被催化氧化的物质的结构简式为___。
(5)D生成E的化学方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】酸雨的主要成分是H2SO4,以下是形成途径之一:①NO2+SO2=NO+SO3,②2NO+O2=2NO2,③SO3+H2O=H2SO4,以下叙述错误的是
A. NO2由反应N2+2O2![]() 2NO2生成
2NO2生成
B. 总反应可表示为2SO2+O2+2H2O![]() 2H2SO4
2H2SO4
C. 还可能发生的反应有4NO2+O2+2H2O=4HNO3
D. 还可能发生的反应有4NO+3O2+2H2O=4HNO3
查看答案和解析>>
科目: 来源: 题型:
【题目】查耳酮常用作有机合成试剂和指示剂,其结构如图所示。下列说法错误的是( )

A.查耳酮的分子式为C15H12O
B.查耳酮分子中所有的碳原子可能共平面
C.查耳酮能发生加聚反应制备高分子
D.查耳酮的同分异构体中含有碳氧双键、碳碳双键且两苯环不直接相连的共有6种(不考虑立体异构)
查看答案和解析>>
科目: 来源: 题型:
【题目】电解100mL含c(H+)=0.3mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )
A. 0.10mol/LAg+B. 0.20mol/LZn2+C. 0.20mol/LCu2+D. 0.20mol/LPb2+
查看答案和解析>>
科目: 来源: 题型:
【题目】铼(Re)是熔点和沸点较高的金属单质之一,用于制造高效能喷射引擎和火箭引擎。从辉钼矿氧化焙烧后的烟道灰(主要成分有SiO2、Re2O7、MoO3、CuO、Fe3O4)中提取铼粉的流程如图:
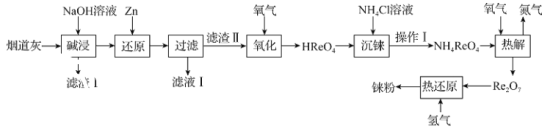
已知:
I.过铼酸(HReO4)是易溶于水的一元强酸,但不具有强氧化性。
II.过铼酸铵(NH4ReO4)是白色片状晶体,微溶于冷水,溶于热水。
回答下列问题:
(1)“碱浸”时,Re2O7和MoO3与NaOH发生以下反应:Re2O7+2NaOH=2NaReO4+H2O;MoO3+2NaOH=Na2MoO4+H2O,则“滤渣I”的成分为___。
(2)①“还原”时,Zn被氧化成ZnO![]() ,NaReO4被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为___。
,NaReO4被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为___。
②分别在20℃和60℃条件下进行“还原”时,溶液中Re和Zn的含量变化如图中曲线所示,若不考虑时间对还原反应的影响,“还原”时,最好选择的温度为___。

(3)通氧气进行“氧化”时,往往进行加压,目的是___。“氧化”时,若生成376.5g过铼酸,理论上消耗标准状况下氧气的体积为___ L。
(4)“沉铼”时,加入热NH4Cl溶液至产生白色沉淀,为使沉淀充分析出并分离得到纯净NH4ReO4晶体,“操作I”包括___、洗涤、干燥。
(5)为提高铼的纯度,“过滤”得到的NH4ReO4需进行提纯,提纯所用的方法是___。
(6)“热解”时,发生反应的化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com