
科目: 来源: 题型:
【题目】下列说法错误的是( )
A.一定温度下,反应MgCl2(l)=Mg(1)+Cl2(g)的 △H>0 △S>0
B.用N2(g)+3H2(g)=2NH3(g)△H<0设计的燃料电池,N2(g)在正极上进行反应
C.氯化镁溶液加热蒸干得不到纯净氯化镁固体
D.常温下,向饱和![]() 溶液中加少量
溶液中加少量![]() 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下
粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下![]()
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】工业炼铁过程中涉及到的主要反应有:
i.C(s)+O2(g)=CO2(g)△H1=-393kJ/mol
ii.C(s)+CO2(g)=2CO(g)△H2=+172kJ/mol
iii.Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)△H3
2Fe(s)+3CO2(g)△H3
iv.2Fe2O3(s)+3C(s)![]() 4Fe(s)+3CO2(g)△H4=+460kJ/mol
4Fe(s)+3CO2(g)△H4=+460kJ/mol
回答下列问题:
(1)反应iv_________(填“能”或“不能”)在任何温度下自发进行。
(2)△H3=_________kJ/mol。
(3)T1时,向容积为10L的恒容密闭容器中加入3molFe2O3和3molCO发生反应iii,5min时达到平衡,平衡时测得混合气体中CO2的体积分数为80%。
①0~5min内反应的平均速率v(CO2)=_________molL-lmin-l。
②该温度下反应的平衡常数为_________。
③若将平衡后的混合气体通入1L3.6mol/L的NaOH溶液,恰好完全反应,反应的离子方程式为_________,所得溶液中离子浓度由大到小的顺序是_________
④下列选项中能够说明该反应已经达到平衡状态的是_________(填序号)。
a.Fe2O3的物质的量不再变化
b.体系的压强保持不变
c.混合气体的平均摩尔质量保持不变
d.单位时间内消耗CO和生成CO2的物质的量相等
(4)一定条件下进行反应iii,正向反应速率与时间的关系如图所示,t2时刻改变了一个外界条件,可能是_________。
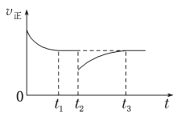 .
.
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素中电负性最大的为_________(填元素符号)。
(2)下列关于CH4和CO2的说法不正确的是_________(填序号)。
a.固态CO2属于分子晶体
b.CH4分子中含有极性共价键,是非极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp2
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni原子的核外电子排布式为_______,Ni元素位于元素周期表的第_________族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1molNi(CO)4中含有_________molσ键。
③某镍白铜合金的立方晶胞结构如图所示。
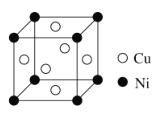
该晶体中距离Ni原子最近的Cu原子有_________个,若合金的密度为dg/cm3,阿伏加德罗常数的数值为NA,晶胞边长a=_________cm。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组收集了一种合金进行以下探究(已知铜元素的焰色反应呈绿色)。
(1)外观暗灰色,表皮光滑;
(2)在酒精灯外焰上灼烧,火焰呈绿色,合金片熔化,但不滴落;
(3)取刮去表皮的合金10 g,放入足量的稀硫酸中,收集到标准状况下的H2 8.96 L;
(4)另取刮去表皮的合金10 g,放入足量的NaOH溶液中,也收集到标准状况下的H2 8.96 L。
试据此判断,该合金中一定含有的元素是________(写元素符号);可能含有的元素是________(填选项编号)。
a.Ag b.Mg
c.Na d.Fe
如果该合金中只含2种元素,则二者的质量比是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为2H2S(g)+O2(g)=S2(s)+2H2O(l) ΔH=-632kJ·mol-1。如图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
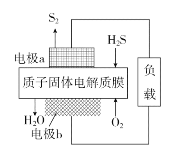
A.电池工作时,电流从电极a经负载流向电极b
B.电极a上发生的电极反应为2H2S-4e-=S2+4H+
C.当反应生成64gS2时,电池内部释放632kJ热能
D.当电路中通过4mol电子时,有4molH+经质子膜进入负极区
查看答案和解析>>
科目: 来源: 题型:
【题目】25°C时,将0.1mol/LNaOH溶液加入20mL0.1mol/LCH3COOH溶液中,所加入溶液体积(V)和混合液的pH关系曲线如图所示。下列结论正确的是
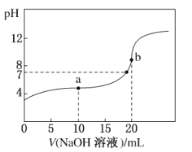
A.pH=7时,c(CH3COO-)+c(CH3COOH)=c(Na+)
B.a点所示的溶液中c(CH3COOH)>c(CH3COO-)
C.b点所示的溶液中c(CH3COOH)+c(H+)=c(OH-)
D.a、b两点所示的溶液中水的电离程度相同
查看答案和解析>>
科目: 来源: 题型:
【题目】水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。下列说法正确的是
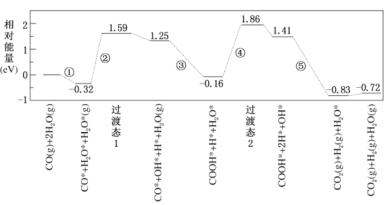
A.水煤气变换反应的△H>0
B.步骤③的化学方程式:CO*+OH*+H2O(g)=COOH*+H2O*
C.步骤⑤只有非极性键HH键形成
D.该历程中最大能垒(活化能)E正=1.70eV
查看答案和解析>>
科目: 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的制备与工业生产相符的是
A.N2![]() NO
NO![]() HNO3
HNO3
B.浓HCl![]() Cl2
Cl2![]() 漂白粉
漂白粉
C.MgCl2(aq)![]() 无水MgCl2
无水MgCl2![]() Mg
Mg
D.饱和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com