
科目: 来源: 题型:
【题目】(1)用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度为___ mol·L-1。
(2)若从中取出50 mL,其物质的量浓度为___ mol·L-1;溶质的质量为___ g。
(3)若将这50 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为___ mol·L-1,SO42-的物质的量浓度为___ mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】富硼渣中含有镁硼酸盐(2MgO·B2O3)、镁硅酸盐(2MgO·SiO2)及少量Al2O3、FeO 等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(H3BO3)晶体的一种工艺流程如下:
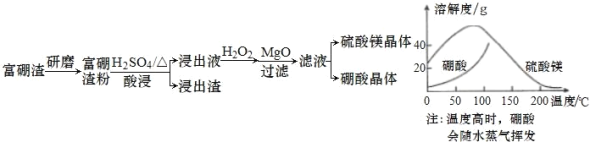
为了获得晶体,会先浓缩溶液接近饱和,然后将浓缩液放入高压釜中,控制温度进行结晶(硫酸镁与硼酸溶解度随温度的变化如图)。下列说法错误的是
A.该工艺流程中加快反应速率的措施有 2 种
B.在高压釜中,先降温结晶得到硼酸晶体,再蒸发结晶得到硫酸镁晶体
C.“酸浸”中镁硼酸盐发生反应2MgO·B2O3+2H2SO4+H2O![]() 2MgSO4+2H3BO3
2MgSO4+2H3BO3
D.加入“MgO”后过滤,所得滤渣主要是Al(OH)3 和Fe(OH)3
查看答案和解析>>
科目: 来源: 题型:
【题目】有关热化学方程式书写与对应表述均正确的是( )
A. 稀硫酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l)△H = +57.3 kJ·mol-1
B. 在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) △H = +285.5 kJ·mol-1
C. 已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1, 则可知C的燃烧热大于110.5 kJ·mol-1
D. 2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
查看答案和解析>>
科目: 来源: 题型:
【题目】为解决日益加剧的温室效应等问题,科学家正在研究建立如下图所示的二氧化碳新循环体系:
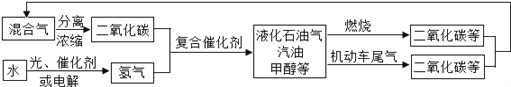
上述关系图能反映的化学观点或化学思想有:( )
①化学变化中元素种类是不变的;②燃烧时化学能可以转化为热能和光能;
③光能或电能可以转化为化学能;④无机物和有机物可以相互转化;
⑤二氧化碳可成为一种重要的资源。
A. ①②③④ B. ①②③⑤ C. ①②④⑤ D. ①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】向含有淀粉的 KIO3 酸性溶液滴加 NaHSO3 溶液,溶液先变蓝后褪色。下列说法错误的是
A.溶液先变蓝的原因:2IO![]() +5HSO
+5HSO![]() =I2+5SO
=I2+5SO![]() +H2O+3H+
+H2O+3H+
B.溶液恰好褪色时 n(KIO3):n(NaHSO3)=1:3
C.还原性 I-> HSO![]() >I2
>I2
D.若向含有淀粉的 NaHSO3 溶液中滴加过量 KIO3 酸性溶液,则溶液变蓝不褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室配制500 mL 0.2 mol/L的FeSO4溶液,实验操作步骤有:
①在天平上称出27.8 g绿矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解
②把制得的溶液小心地注入500 mL容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度1~2 cm处。改用胶头滴管小心滴加蒸馏水至溶液
凹液面底部与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶并轻轻摇匀
⑤将容量瓶塞塞紧,充分摇匀
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)________________________。
(2)本实验用到的基本仪器有__________________________________________。
(3)某同学观察液面的情况如图所示,对所配溶液浓度有何影响?会________(填“偏高”、“偏低”或“无影响”)。
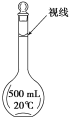
(4)若出现如下情况,所配溶液浓度将偏高还是偏低:
没有进行操作步骤④,会________; 加蒸馏水时不慎超过了刻度,会______。
(5)若实验过程中出现如下情况应如何处理?
加蒸馏水时不慎超过了刻度,应____________________________________;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面, 应________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将 SO2 分别通入无氧、有氧的浓度均为 0.1 mol·L-1的 BaCl2 溶液和 Ba(NO3)2 溶液中,除 BaCl2 溶液(无氧)外,都产生白色沉淀。实验测得各溶液 pH 变化曲线如图:
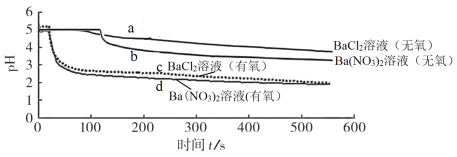
下列说法正确的是
A.曲线a所示溶液pH降低的原因:SO2+H2O![]() H2SO3
H2SO3![]() H++HSO
H++HSO![]()
B.依据曲线b可推知0.2 mol·L-1KNO3溶液(无氧)能氧化SO2
C.曲线c所示溶液中发生反应的离子方程式为:Ba2++SO2+O2=BaSO4↓
D.曲线d所表示的过程中NO![]() 是氧化SO2的主要微粒
是氧化SO2的主要微粒
查看答案和解析>>
科目: 来源: 题型:
【题目】近期,美国某研究小组在《Nature Energy》报道了一种 CO2 电解装置,膜界面处的离子通过中间通道重组直接制备高纯 HCOOH 溶液,其工作原理如图。下列说法正确的是

A.a 电极连接直流电源的正极
B.该电解池工作原理2CO2+2H2O![]() 2HCOOH+O2
2HCOOH+O2
C.M、N 分别是阴离子交换膜、阳离子交换膜
D.电路中转移 1mole- 时,阳极产生 5.6LO2
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列化学仪器:①托盘天平;②玻璃棒;③药匙;④烧杯;⑤量筒;⑥容量瓶;⑦胶头滴管。
(1)现需要配制500 mL 1 mol/L硫酸溶液,需用质量分数为98%、密度为1.84 g/cm3的浓硫酸________mL。
(2)从上述仪器中,按实验使用的先后顺序,其编号排列是_______。
(3)容量瓶使用前检验漏水的方法是_______。
(4)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)
①未经冷却趁热将溶液注入容量瓶中,_______________;
②摇匀后发现液面低于刻度线再加水,_____________;
③容量瓶中原有少量蒸馏水,_______________;
④定容时观察液面俯视,_____________;
⑤未将洗涤液注入容量瓶中,_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
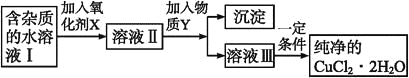
已知某温度下:Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)加入氧化剂X的目的是_______________________。
(2)最适合作氧化剂X的是___________(填编号,否则不给分);写出氧化剂X参与的离子反应方程式_________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)为了除去Fe3+,需加入物质Y_________(填化学式)调节溶液的pH值为___________。
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________(填“能”或“不能”);若能,不用回答;若不能,回答该如何操作?____________________。
(5)常温下已知Fe(OH)3的Ksp=1.0×10-35,向500mL 0.2mol/L的FeCl3溶液中加入NaOH固体(溶液体积变化忽略不计)后pH=3.0,则需要加入氢氧化钠固体的质量为________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com