
科目: 来源: 题型:
【题目】在密闭容器中,进行下列反应:2A(g)+B(g)+C(g)![]() D(g)+E(g) ΔH>0,达到平衡后,下列说法中正确的是( )
D(g)+E(g) ΔH>0,达到平衡后,下列说法中正确的是( )
A.若恒温定容情况下,充入一些稀有气体,压强增大,平衡向右移动
B.若恒温定压条件下,加入C,则C的转化率将增大
C.若定容升温,在新平衡体系中A的质量分数将减小
D.温度、压强和容积都相同时,在另一密闭容器中加入2molA、1molB、1molC,平衡时两个容器中D和E的浓度分别相等
查看答案和解析>>
科目: 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目: 来源: 题型:
【题目】四种短周期元素X、Y、Z、W的最外层电子数之和为16,其中X、Y、Z的电子层数相同,W原子的核外电子层数与其他三种不同,X元素的焰色反应呈黄色,Y元素能形成多种单质,其中一种单质在空气中易自燃,Z元素的最外层电子数是K层的2倍。下列推断正确的是( )
A.原子半径:X<Y
B.简单离子半径:W>X>Y
C.Z和W形成的化合物和某些酸、强碱均能发生反应
D.X、Y、W和氢元素形成的化合物的水溶液一定呈碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
I.(配制酸性KMnO4标准溶液)如图是配制50 mL酸性KMnO4标准溶液的过程示意图。
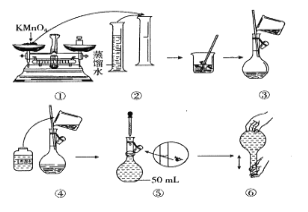
(1)请你观察图示判断其中不正确的操作有____(填序号)。
(2)其中确定50 mL溶液体积的容器是____(填名称)。
(3)如果按照图示的操作所配制的溶液进行实验,在其他操作均正确的情况下,所测的实验结果将_______(填“偏大”或“偏小”)。
II.(测定血液样品中Ca2+的浓度)抽取血样20. 00 mL,经过上述处理后得到草酸,再用0.020 mol/L酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL酸性KMnO4溶液。
(4)已知草酸与酸性KMn04溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mnx++10CO2↑+8H2O,则式中的x=____。
(5)滴定时,根据现象____,即可确定反应达到终点。
(6)经过计算,血液样品中Ca2+的浓度为____mg.cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】“侯氏制碱法”是我国化工专家侯德榜为世界制碱工业作出的突出贡献。某实验小组模拟“侯氏制碱法”的工艺流程及实验装置(部分夹持装置省略)如图:下列叙述正确的是( )
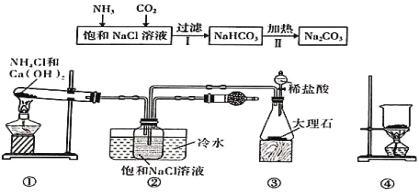
A.实验时先打开装置③中分液漏斗的旋塞,过一段时间后再点燃装置①的酒精灯
B.装置②的干燥管中可盛放碱石灰,作用是吸收多余的NH3
C.向步骤 I 所得滤液中通入氨气,加入细小的食盐颗粒并降温可析出NH4Cl
D.用装置④可实现步骤Ⅱ的转化,所得CO2可循环使用
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关系式中,正确的是
A. 等浓度等体积的CH3COOH和CH3COONa溶液混合:c(CH3COO- )+c(OH-)=c(H+)+c(CH3COOH)
B. 常温下,0.1 mol·L-1HA溶液与0.1 mol·L NaOH溶液等体积完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH )=c(H+)
C. 常温下,0.1 mol·L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S)
D. 常温下,将0.1 mol·L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中c(CHCOO-)/c(CHCOOH)的值增大到原来的100倍
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列物质:①稀硫酸 ②小苏打 ③氨水 ④二氧化碳 ⑤FeCl3固体 ⑥稀NaOH溶液 ⑦硝酸亚铁溶液。
(1)上述物质中属于电解质的物质序号为______ 。
(2)有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是______。
(3)加入盐酸、NaOH溶液均能发生化学反应的物质序号为______。
(4)能导电的物质序号为_______________。
(5)④与⑥充分反应后,将溶液小火蒸干,得到固体混合物。固体组成成分可能是(用化学式表示)___________________________。
(6)实验室用⑤制备胶体的化学方程式为__________________________________。如果将1molFeCl3全部制成胶体,制得的胶体________(选填“带负电”“电中性”“带正电”),胶粒数目________NA(选填“大于”“等于”“小于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是

A.31d和33d属于同种核素
B.气态氢化物的稳定性:a>d>e
C.工业上常用电解法制备单质b
D.a和b形成的化合物不可能含共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组设计了如图所示的数字化实验装置,研究常温下,向1L0.1mol/L H2A溶液中逐滴加入等浓度NaOH溶液时的pH变化情况,并绘制出溶液中含A元素的微粒的物质的量分数与溶液pH的关系如图所示,则下列说法中不正确的是( )
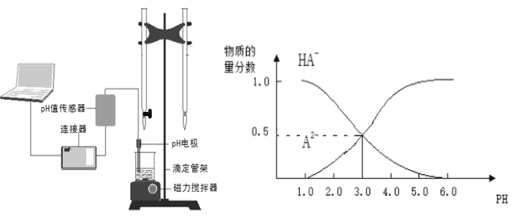
A.pH=4.0时,图中n(HA-)约为0.0091mol
B.该实验应将左边的酸式滴定管换成右边碱式滴定管并加酚酞作指示剂
C.常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
D.0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com